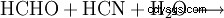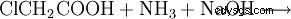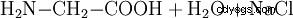| wzór strukturalny | ||
|---|---|---|
| Ogólne | ||
| nazwa | Glicyna | |
| Skrót | Gly, G | |
| Reszta nazwy | glicyl | |
| niezbędne | nie | |
| Inne nazwy | Glikol, Glikol, Kwas Aminooctowy | |
| Formuła molekularna | C2 H5 NIE2 | |
| Numer CAS | 56-40-6 | |
| Krótki opis | białe ciało stałe | |
| Właściwości | ||
| Masa molowa | 75,07 g/mol | |
| Stan materii | naprawiono | |
| Gęstość | 1,595 g/cm | |
| Temperatura topnienia | 450-500°F | |
| Temperatura wrzenia | > Rozkład termiczny 230 °C | |
| Prężność par | Pa (°C) | |
| łańcuch boczny | brak łańcucha bocznego, w przeciwnym razie hydrofilowy | |
| Rozpuszczalność | dobry w wodzie (225 g/l przy 20 °C), ubogi w alkohol, nierozpuszczalny w rozpuszczalnikach niepolarnych | |
| punkt izoelektryczny | 6.06 | |
| wartości pK przy 25 °C | pKCOOH :2,4 pKNH2 :9,8 | |
| objętość van der Waalsa | 48 | |
| Ocena hydrofobowości | -0,4 | |
| Instrukcje bezpieczeństwa | ||
| ||
| Zwroty R i S | R:brak wyrażeń ryzyka S:bez fraz S | |
| MAK | nie ustawiono | |
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | ||
Glicyna (chemicznie nazywany kwasem aminooctowym) jest najmniejszym i najprostszym aminokwasem proteinogennym. Należy do grupy aminokwasów hydrofilowych i jest jedynym aminokwasem proteinogennym, który nie jest chiralny i dlatego nie jest aktywny optycznie.
Glicyna nie jest niezbędna, więc może być wytwarzana przez sam organizm ludzki i jest ważnym składnikiem prawie wszystkich białek i ważnym węzłem w metabolizmie.
Nazwa pochodzi od słodkiego smaku czystej glicyny (gr. glicys :Słodki).
Synteza
Glicyna powstaje między innymi w reakcji formaldehydu, cyjanowodoru i wody:
Reakcja ta ma szczególne znaczenie ze względu na hipotezę, że materiały wyjściowe mogły powstać z tzw. pierwotnej atmosfery, która otaczała Ziemię około 4 miliardów lat temu. Miała prawdopodobnie zrobiony z wodoru (H2 ), hel (He) i w mniejszym stopniu metan (CH4 ), amoniak (NH3 ) i kilka innych gazów szlachetnych.
Chemicznie glicynę można również wytworzyć z kwasu monochlorooctowego i amoniaku:
W organizmie większość glicyny jest pozyskiwana z pożywienia, ale można ją również wytwarzać z seryny.
Funkcje
Metabolizm
Oprócz wytwarzania glicyny, konwersja seryny do glicyny służy również do konwersji kwasu tetrahydrofoliowego do kwasu N-N-metylenotetrahydrofoliowego, który jest wymagany między innymi do syntezy nukleotydów tyminy (składnik DNA).
Glicyna jest również potrzebna bezpośrednio do syntezy innych składników materiału genetycznego (puryn). Służy również do biosyntezy hemu (wiązanie tlenu we krwi), kreatyny (magazynowanie energii w mięśniach) lub glutationu.
Jako tak zwany aminokwas glukogenny, glicyna może zostać przekształcona w glukozę poprzez pirogronian w ramach metabolizmu.
Toksyczny kwas szczawiowy może również powstawać z glicyny jako produktu ubocznego.
Jest szczególnie powszechny w kolagenie, najpowszechniejszym białku organizmów zwierzęcych. Tutaj stanowi dobrą jedną trzecią wszystkich aminokwasów, ponieważ jego mały rozmiar pozwala kolagenowi zwinąć się w strukturę potrójnej helisy.
układ nerwowy
Glicyna działa w ośrodkowym układzie nerwowym za pośrednictwem receptora glicyny jako neuroprzekaźnik hamujący, czyli jako hamująca substancja sygnalizacyjna. Działa poprzez otwieranie kanałów chlorkowych bramkowanych ligandami, co prowadzi do hamującego potencjału postsynaptycznego (IPSP), który zmniejsza aktywność neuronów w dół.
Komórki nerwowe uwalniające glicynę (neurony glicynergiczne) znajdują się głównie w rdzeniu kręgowym i hamują tak zwane neurony ruchowe rogu przedniego, co powoduje zmniejszenie aktywności mięśni unerwionych przez komórki.
Strychnina, antagonista receptora glicyny oraz toksyna tężcowa, która hamuje uwalnianie glicyny, powodują zmniejszenie działania glicyny. Utrata inhibicji zwiększa aktywność mięśni. Może to prowadzić do zagrażających życiu skurczów.
Wykorzystanie
Glicyna jest dodawana do żywności jako wzmacniacz smaku.
Glicyna i jej sól sodowa są oznaczone numerem E 640 jako dodatek do żywności w UE Ogólnie zatwierdzone do żywności bez ograniczeń maksymalnej ilości, skutki zdrowotne nie są znane.
Referencje
- G. Löffler, P.E. Petrides:Biochemia i patobiochemia , wydanie 7, Springer Verlag, 2003, ISBN 3-540-42295-1