| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
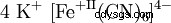 | |||||||
| Allgemeines | |||||||
| Nazwa | Kaliumhexacyanidoferrat(II) | ||||||
| Kolejne imię |
| ||||||
| Wzór sumy | C6 FeK4 N6 | ||||||
| Numer CAS |
| ||||||
| Zmiana schematu | Zitronengelbe Kristalle | ||||||
| Właściwości własne | |||||||
| Masa molowa | 368,34 g·mol (wasserfrei) | ||||||
| Zagregowanie | festiwal | ||||||
| Wyłączenie | 1,85 g/cm (wasserfrei) | ||||||
| Schmelzpunkt | od ok. 70 °C Kristallwasserabgabe des Trihydrats | ||||||
| Siedepunkt | > 400 °C (zerowanie) | ||||||
| Zamknij | gut löslich w Wasser:337 g/l (20 °C) | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| MAK | nicht festgelegt | ||||||
| WGK | 2 | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Heksacyjanidoferrat(II) wapnia ist ein Salz mit der Konstitutionsformel K4 [Fe(CN)6 ]. Es wird auch als Kaliumferrocyanid , Gelbes Blutlaugensalz oder Gelbkali bezeichnet. Man findet noch häufig die Bezeichnung Kaliumhexacyanoferrat(II) nach älterer Nomenklatur der IUPAC. Es ist w Wasser und Aceton gut, w etanolu i eterze nicht löslich. Die wässerige Lösung zersetzt sich im Licht allmählich unter Bildung von Fe(OH)3 .
Rozwinięcie
Hergestellt wird Kaliumhexacyanidoferrat(II) aus einer Eisen(II)-Salzlösung und Kaliumcyanid. Es enthält dann Kristallwasser und Liegt als K4 [Fe(CN)6 ]·3H2 O (Caliumhexacyanidoferrat(II)-Trihydrat) vor. Oberhalb von 60 °C gibt es das Kristallwasser wieder ab und geht in ein farbloses Pulver über, bei 100 °C ist es wasserfrei. Bei noch stärkerem Erhitzen zerfällt es unter Bildung von Kaliumcyanid (KCN), FeC2 i N2 .
Unter Normalbedingungen ist das Hexacyanidoferrat(II)-Ion jedoch ein stabiler Komplex, es ist daher ungiftig.
Früher wurde Kaliumhexacyanidoferrat(II) durch Glühen von eingetrocknetem Blut, Hornspänen und anderen tierischen Substanzen mit Eisenspänen und Pottasche hergestellt, daher auch die Bezeichnung als Gelbes Blutlaugensalz.
Rozszerzenie
In der Analytik wird das Salz zum Nachweis von Eisen(III)-Ionen verwendet. W Lösung erhält man bei Zugabe von Fe-Ionen zunächst lösliches Berliner Blau, K[FeFe(CN)6 ], durch einen Überschuss fällt unlösliches Berliner Blau aus, Fe[FeFe[(CN)6 ]3 . Diese Reaktionen dienen zum Nachweis von Eisen(III)-Ionen:
Aus Kaliumhexacyanidoferrat(II) lässt sich durch Oxidation mit Wasserstoffperoxid Kaliumhexacyanidoferrat(III) herstellen.
In der Lebensmittelindustrie wird Kaliumhexacyanidoferrat als Trennmittel und Stabilisator verwendet. Es darf in Lebensmitteln jedoch nur in geringen Mengen verwendet werden, da sich beim Erhitzen oder bei Einwirkung von Säuren Blausäure bilden kann.Es ist in der EU als Lebensmittelzusatzstoff der BezeichnungE536 ausschließlich für die Verwendung in Kochsalz und Kochsalzersatz zugelassen.
Quellen
- ↑ Eintrag zu Kaliumhexacyanidoferrat(II) in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31.8.2007 (JavaScript erforderlich)
- Kaliumhexacyanidoferrat(III) (rotes Blutlaugensalz)
- Cyjanek

