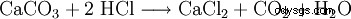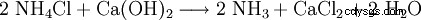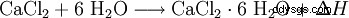| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Brak dostępnej formuły strukturalnej | |||||||
| Ogólne | |||||||
| Nazwa | Chlorek wapnia | ||||||
| Inne nazwy |
| ||||||
| Formuła molekularna | CaCl2 | ||||||
| Numer CAS | 10043-52-4 (bezwodny) 10035-04-8 (dihydrat) 25094-02-4 (tetrahydrat) 07774-34-7 (heksahydrat) | ||||||
| Krótki opis | bezbarwne i bezwonne, higroskopijne kryształy | ||||||
| Właściwości | |||||||
| Masa molowa | 110,98 g mol (bezwodny) 147,02 g mol (dihydrat) 182,04 g mol (tetrahydrat) 219,08 g mol (heksahydrat) | ||||||
| Stan materii | naprawiono | ||||||
| Gęstość | 2,16 g cm (bezwodny) 1,85 g cm (dwuwodny) 1,71 g cm (sześciowodny) | ||||||
| Temperatura topnienia | 782 °C (bezwodny) ok. 176 °C (dwuwodzian) ok. 35 °C (tetrahydrat) | ||||||
| Temperatura wrzenia | 1935 °C | ||||||
| Ciśnienie pary | 11 hPa | ||||||
| Rozpuszczalność |
łatwo rozpuszczalny w wodzie:740 g l (20 °C) | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
| Struktura krystaliczna ||Rutyl (zniekształcony), oktaedrycznychlorek wapnia (także chlorek wapnia ) jest chlorkiem wapnia metalu ziem alkalicznych o wzorze cząsteczkowym CaCl2 . Wapń ma stopień utlenienia +2, chlor ma stopień utlenienia -1.
Historia
Około 1860 roku chemikom Robertowi Wilhelmowi Bunsenowi i Matthiessenowi udało się po raz pierwszy oczyścić pierwiastek wapnia poprzez elektrolizę chlorku wapnia.
Zdarzenia
Chlorek wapnia występuje w naturze rozpuszczony w solankach.
Uzyskiwanie i wyświetlanie
Chlorek wapnia składa się z kwasu solnego i węglanu wapnia:
Późniejsze podgrzanie do 260 °C zapewnia postać bezwodną.
Technicznie chlorek wapnia jest otrzymywany jako produkt odpadowy z produkcji sody w procesie Solvaya, a mianowicie, gdy amoniak jest odzyskiwany z produkowanego chlorku amonu:
Właściwości
Chlorek wapnia jest solą. Wapń i chlor występują jako jony z powodu dużej różnicy elektroujemności. Wiązanie odbywa się zatem poprzez interakcje elektrostatyczne.
W czystej postaci chlorek wapnia tworzy bezbarwne kryształy i jest wysoce higroskopijny, gdy jest bezwodny. Z łatwością wchłania wodę z otoczenia, tworząc kompleks hydratów.
Reakcje
Chlorek wapnia reaguje z wodą, tworząc kompleks heksahydratu i wytwarza dużo ciepła (egzotermiczny, ΔH> 0):
Kryształy heksahydratu rozpuszczają się we własnej wodzie krystalizacyjnej w temperaturze około 30 °C. Związana woda jest ponownie uwalniana przez podgrzanie do około 200 °C. Rozpuszczanie w wodzie, w przeciwieństwie do bezwodnego chlorku wapnia, prowadzi do silnego ochłodzenia. Obie formy chlorku wapnia są również łatwo rozpuszczalne w etanolu.
Wykorzystanie
Ze względu na swoją higroskopię bezwodny chlorek wapnia jest ważnym środkiem suszącym w laboratorium, na przykład w eksykatorze oraz w chemii technicznej dla szerokiej gamy gazów i cieczy. Obszary zastosowania to suszenie pomieszczeń mieszkalnych, zastosowanie jako środek przeciw zamarzaniu, w szczególności jako środek przeciw zamarzaniu i przyspieszacz wiązania w betonie oraz jako środek wiążący kurz (np. na budowach). W medycynie służy do zatrzymywania krwawienia i leczenia chorób niedoboru wapnia, a także do leczenia odmrożeń i alergii.
Jest stosowany jako środek ujędrniający, wzmacniacz smaku i stabilizator (np. w uzdatnianiu wody pitnej, obróbce powierzchni owoców).W UE jest oznaczony numerem E 509 jako dodatek do żywności zatwierdzone.
Chlorek wapnia jest używany do podgrzewania gotowych do spożycia napojów poprzez wykorzystanie hydratacji egzotermicznej podczas reakcji z wodą. Jest również używany jako sól drogowa i do produkcji mieszanek chłodzących (patrz wyżej ).
Wykorzystywany jest również do koagulacji białek w technologii żywności i jest używany do produkcji produktów takich jak tofu czy sztuczny kawior.
Źródła
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 maja. 2007