| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| Generale | |||||||
| Nome | Solfato di sodio | ||||||
| Altri nomi | solfato disodico, E 514, sale di Glauber (Na2 SO4 · 10H2 O) | ||||||
| Formula molecolare | Na2 SO4 | ||||||
| Numero CAS | 7757-82-6 | ||||||
| Breve descrizione | cristalli incolori e inodori | ||||||
| Proprietà | |||||||
| Massa molare | 142,04 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2,70 g cm | ||||||
| Punto di fusione | 884 °C | ||||||
| Punto di ebollizione | 1689 °C | ||||||
| Solubilità | buono in acqua:170 g/l, a 20 °C | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Solfato di sodio (Na2 SO4 , nome obsoleto Solfato di sodio ) è un sale sodico dell'acido solforico ed è costituito da due cationi Na (Na) e dall'anione solfato (SO4 ) insieme. Il decaidrato (Na2 SO4 · 10H2 O) è anche chiamato Glaubersalz dal chimico Johann Rudolph Glauber Chiamato anche sale di Carlsbad , che si ottiene facendo evaporare l'acqua minerale di Karlovy Vary, è costituita principalmente da solfato di sodio decaidrato e viene utilizzata come lassativo, come il sale di Glauber.
Cronologia
Il solfato di sodio fu prodotto e descritto intorno al 1655 dal chimico e farmacista Johann Rudolph Glauber. Egli stesso chiamò il sale da lui scoperto Sal mirabilis e Mirabili .
Ottenere e visualizzare
Il solfato di sodio viene estratto raramente da minerali naturali, poiché è spesso un sottoprodotto delle reazioni dell'industria chimica in cui l'acido solforico viene neutralizzato con soda caustica. Un'altra possibilità di rappresentazione tecnica è la reazione del salgemma (NaCl) con acido solforico per ottenere acido cloridrico con solfato di sodio come sottoprodotto (a 800°C):
-
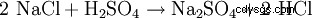
- Il cloruro di sodio e l'acido solforico reagiscono per formare solfato di sodio e acido cloridrico.
Il solfato di sodio può essere prodotto in laboratorio dalle seguenti reazioni:
-

- Il sodio e l'acido solforico reagiscono per formare solfato di sodio e idrogeno.
-
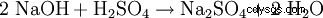
- Durante la neutralizzazione della soda caustica con acido solforico si producono solfato di sodio e acqua.
Proprietà
Il solfato di sodio anidro fonde a 884 °C, è igroscopico e facilmente solubile in acqua quando riscaldato (calore della soluzione). Al contrario, il decaidrato si dissolve sotto un forte raffreddamento, a causa del cosiddetto effetto entropia. Il solfato di sodio decaidrato è un componente di molte acque minerali e si scioglie lentamente nella propria acqua cristallina a partire da circa 32 °C. Il sale anidro si separa da questa soluzione, che è sovrasatura di solfato di sodio anidro.
Utilizzo
Il solfato di sodio è utilizzato nei detergenti come riempitivo, in medicina come lassativo, nella produzione della pasta (processo solfato) e nell'industria del vetro, tessile e delle vernici. Il solfato di sodio anidro ricotto viene utilizzato in laboratorio per essiccare i solventi organici. Sodio solfato decaidrato (sale di Glauber ) viene utilizzato come materiale lassativo e di accumulo di calore latente.
Nella tecnologia alimentare, viene utilizzato come agente rassodante, regolatore di acidità e sostanza veicolante.Il solfato di sodio e l'acido solfidrico di sodio sono additivi alimentari numerati E 514 nell'UE senza limite massimo (quantum satis ) generalmente approvato per gli alimenti.
Fonti
- ↑ https://www.zusatzstoffe-online.de/zusatzstoffe/216.e514_natriumsulfate.html
