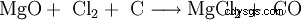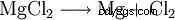| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Nessuna formula strutturale disponibile | |||||||
| Generale | |||||||
| Nome | Cloruro di magnesio | ||||||
| Altri nomi | E511 | ||||||
| Formula molecolare | MgCl2 | ||||||
| Numero CAS | 7786-30-3 (anidro) 7791-18-6 (esaidrato) | ||||||
| Breve descrizione | cristalli bianchi | ||||||
| Proprietà | |||||||
| Massa molare | 95,21 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2,32 g cm | ||||||
| Punto di fusione | 708 °C | ||||||
| Punto di ebollizione | 1412 °C | ||||||
| Pressione di vapore | 0,1 mbar (650°C) | ||||||
| Solubilità | 542 g/L (20°C) | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | 20 mg m | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Cloruro di magnesio , MgCl2 , è il sale di magnesio dell'acido cloridrico. Forma diversi idrati.
Occorrenze
Il cloruro di magnesio si trova naturalmente nella carnallite minerale (KMgCl3 · 6H2 0) come doppio sale. Un'altra fonte naturale è l'acqua di mare. Ecco il sale più comune dopo il cloruro di sodio.
Ottenere e visualizzare
L'estrazione tecnica del cloruro di magnesio viene effettuata evaporando i liquidi finali dalla produzione di cloruro di potassio. Innanzitutto, il cloruro di magnesio esaidrato (MgCl2 · 6H2 O) ricevuto. Un'ulteriore evaporazione produce un prodotto con un contenuto di acqua inferiore. Il cloruro di magnesio anidro si ottiene facendo reagire l'ossido di magnesio con coke e cloro:
In laboratorio, il cloruro di magnesio può essere ottenuto da idrossido di magnesio e acido cloridrico
oppure facendo reagire il magnesio con l'acido cloridrico
essere vinto.
Proprietà
Il cloruro di magnesio è altamente igroscopico. La sua tendenza all'idrolisi è meno pronunciata di quella del cloruro di alluminio (AlCl3 ). Il cloruro di magnesio anidro cristallizza in CdCl2 -tipo di griglia.
Il cloruro di magnesio esaidrato (numero CAS:7791-18-6) ha una massa molare di 203,3 g mol, una densità di 1,57 g cm e un punto di fusione di circa 117 °C (decomposizione). La solubilità dell'esaidrato è di 1700 g/L (a 20 °C).
Utilizzo
Il cloruro di magnesio viene utilizzato per ottenere il magnesio elementare utilizzando l'elettrolisi a sale fuso:
Viene utilizzato insieme all'ossido di magnesio nei massetti cementizi, come sale stradale e come additivo alimentare con l'etichetta (numero E) E 511. Serve come esaltatore di sapidità artificiale ed è approvato per alimenti biologici.
Inoltre, il cloruro di magnesio viene utilizzato per aumentare la concentrazione di magnesio negli acquari di barriera.
Fonti
- ↑ Banca dati delle sostanze pericolose BGIA Gestis