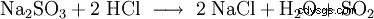| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | Anidride solforosa | ||||||
| Altri nomi | Ossido di zolfo(IV), anidride solforosa | ||||||
| Formula molecolare | SO2 | ||||||
| Numero CAS | 7446-09-5 | ||||||
| Breve descrizione | gas incolore, pungente, tossico | ||||||
| Proprietà | |||||||
| Massa molare | 64,06 g mol | ||||||
| Stato della materia | gassoso | ||||||
| Densità | 2,73 kg m (1 bar, 15°C) | ||||||
| Punto di fusione | -75 °C | ||||||
| Punto di ebollizione | -10 °C | ||||||
| Pressione di vapore | 3,3 bar (21°C) | ||||||
| Solubilità | buono (112 g/l) in acqua | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | 1,3 mg m | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Anidride solforosa , SO2 , è l'anidride dell'acido solforoso H2 SO3 . L'anidride solforosa è un gas incolore e tossico con un odore pungente e un sapore aspro. Viene prodotto principalmente quando vengono bruciati combustibili fossili contenenti zolfo come carbone o prodotti petroliferi, che contengono fino al 4% di zolfo. Di conseguenza, contribuisce in modo significativo all'inquinamento atmosferico, è la causa delle piogge acide, dove l'anidride solforosa viene prima ossidata dall'ossigeno per formare anidride solforosa e poi con l'acqua per formare acido solforico (H2 SO4 ) è implementato. Per evitare ciò, esistono vari processi per la desolforazione dei fumi.
Produzione
- bruciando zolfo o acido solfidrico
- tostando minerali di solfuro
per esempio. B. di pirite:
-

- Il disolfuro di ferro(II) e l'ossigeno reagiscono per formare ossido di ferro(III) e anidride solforosa.
- da solfiti da acidi più forti
Proprietà
| Numero E | 220 |
| temperatura critica | 157,5°C |
| pressione critica | 7,9 bar |
Una formula limite mesomerica dell'anidride solforosa è la seguente:
In termini generali:
L'anidride solforosa liquida dissolve numerose sostanze e si è quindi affermata come un prezioso solvente.
Utilizzo
L'anidride solforosa si trova nell'industria alimentare con il nome E 220 utilizzato come conservante e antiossidante, in particolare per frutta secca, piatti a base di patate, succhi di frutta, marmellate e vino, inoltre viene utilizzato per produrre cloruro di solforile SO2 Cl2 e cloruro di tionile SOCl2 .
Inoltre, l'anidride solforosa è un importante materiale di partenza per la produzione di anidride solforosa, per poi produrre acido solforico concentrato, ad es. B. con il metodo di contatto.
L'anidride solforosa viene anche utilizzata nella produzione di molti prodotti chimici, medicinali e coloranti e nello sbiancamento di carta e tessuti.
Inquinamento
Ad alte concentrazioni, SO2 danneggia l'uomo, gli animali e le piante. I prodotti di ossidazione provocano "piogge acide" che mettono in pericolo ecosistemi sensibili come foreste e laghi e attaccano edifici e materiali.
Le emissioni totali di SO2 sono state notevolmente ridotte nei paesi industrializzati sviluppati negli ultimi due decenni grazie all'uso di combustibili e combustibili a basso contenuto di zolfo o privi di zolfo.
Istruzioni di sicurezza
Una concentrazione di anidride solforosa superiore al valore MAK può causare mal di testa, nausea e sonnolenza nell'uomo. A concentrazioni più elevate, il gas danneggia gravemente bronchi e polmoni o addirittura gli acidi nucleici, portatori di proprietà ereditarie.
Fonti
- ↑ Scheda di sicurezza dei materiali (Praxair)
- ↑ Database delle sostanze pericolose BGIA Gestis
- ↑ Holleman-Wiberg:Libro di testo di chimica inorganica 102a edizione, de Gruyter, Berlino, 2007.