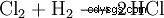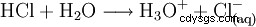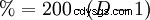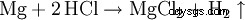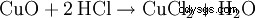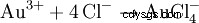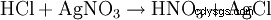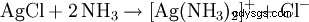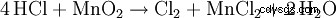| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | Acide chlorhydrique | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | Non applicable | ||||||
| Numéro CAS | 7647-01-0 | ||||||
| Brève description | liquide incolore à jaunâtre avec une odeur piquante | ||||||
| Propriétés | |||||||
| Masse molaire | Non applicable | ||||||
| État de la matière | liquide | ||||||
| Densité | 1,19 g·cm (solution à 37 %) | ||||||
| Point de fusion | −35 °C (solution à 36 %) | ||||||
| Point d'ébullition | 57 °C (solution à 36 %) | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| WGK | 1 - légèrement dangereux pour l'eau | ||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Acide chlorhydrique (nom systématique acide chlorhydrique ) est une solution aqueuse de chlorure d'hydrogène gazeux (formule chimique HCl). C'est un acide inorganique fort et fait partie des acides minéraux. Les sels de l'acide chlorhydrique sont appelés chlorures. Le chlorure le plus connu est le chlorure de sodium (NaCl, sel commun).
Historique
L'acide chlorhydrique devait être connu des premiers alchimistes. Leur découverte est attribuée à Maria Prophetissa au 1er siècle et Geber au 9ème siècle.
Déjà dans la première moitié du XVe siècle, Basilius Valentinus obtenait de l'acide chlorhydrique en faisant réagir de l'halite (sel gemme) avec du vitriol de fer. Johann Rudolph Glauber a réussi à le produire à partir de sel de table et d'acide sulfurique au 17ème siècle. Lavoisier dit acide chlorhydrique acide muriatique (lat. muria =saumure). Les sources salines sont encore appelées sources muriatiques désigné. En Amérique du Nord, l'acide chlorhydrique est aussi appelé acide muriatique appelé.
Occurrences
Dans la nature, l'acide chlorhydrique se trouve dans les gaz volcaniques et en solution diluée dans les lacs de cratère. Il se présente sous forme libre dans le suc gastrique des vertébrés (0,1 à 0,5 % en masse). Les gisements de sels d'acide chlorhydrique sont presque inépuisables, sous forme de sel gemme et dissous dans l'eau de mer.
Obtenir et afficher
L'acide chlorhydrique est produit en laboratoire à partir d'acide sulfurique concentré et de sel commun (d'où son nom) :
L'acide sulfurique déplace le chlorure d'hydrogène de son sel, bien que le chlorure d'hydrogène soit l'acide le plus fort. Ceci est possible car le chlorure d'hydrogène est gazeux et pratiquement insoluble dans l'acide sulfurique. En conséquence, le chlorure d'hydrogène disparaît constamment de l'équilibre. Le sulfate obtenu est l'hydrogénosulfate de sodium, un sel acide.
Dans l'industrie chimique, le chlorure d'hydrogène de haute pureté est obtenu en brûlant du chlore gazeux détonant (un mélange d'hydrogène et de chlore).
Pour compléter l'acide, dissoudre le gaz chlorhydrique dans l'eau :
L'acide chlorhydrique techniquement pur est principalement un sous-produit de la chloration des composés organiques.
Propriétés
| % HCl | g HCl/l | Molarité | Densité |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1 050 |
| 15.5 | 166 | 4.61 | 1 075 |
| 20.4 | 224 | 6,22 | 1 100 |
| 22,3 | 248 | 6,89 | 1 110 |
| 24,3 | 272 | 7.56 | 1 120 |
| 26,2 | 296 | 8,22 | 1 130 |
| 28,2 | 321 | 8.92 | 1 140 |
| 30,1 | 347 | 9.64 | 1 150 |
| 32,1 | 372 | 10,23 | 1 160 |
| 34,2 | 400 | 11,11 | 1 170 |
| 36,2 | 428 | 11.89 | 1 180 |
| 38,3 | 456 | 12.67 | 1 190 |
| 40,4 | 485 | 13,47 | 1 200 |
A 0 °C, le gaz HCl se dissout très bien dans l'eau (si l'eau est encore en phase liquide) (815 g ou 507 l dans un litre). Cela crée de la chaleur. A 25 °C, un litre d'acide chlorhydrique saturé contient 825 g HCl (42,7 %). La densité de la solution est de 1,20 g cm. La dépendance à la concentration de la densité est indiquée dans le tableau ci-contre. Il existe un lien mathématique aléatoire entre la densité et la teneur en pourcentage de HCl :les décimales doublées correspondent à la concentration, par ex. B. 1,10 g cm est la densité de l'acide chlorhydrique à 20 %.
L'acide chlorhydrique avec une teneur en HCl supérieure à 36 % en poids est également appelé acide chlorhydrique fumant indiqué parce qu'une brume blanche se forme sur les vaisseaux ouverts.
L'acide chlorhydrique pur peut être évaporé sans laisser de résidu. Si de l'acide chlorhydrique avec une teneur en HCl supérieure à 20 % en poids est chauffé, il s'échappe plus de HCl que d'eau, jusqu'à ce qu'il reste un mélange de 20 % de HCl et de 80 % d'eau, ce qu'on appelle un azéotrope. La teneur exacte en HCl dans l'azéotrope à 1013 mbar est de 20,17 %, le point d'ébullition est de 110 °C.
HCl se dissocie complètement dans l'eau, l'acide chlorhydrique concentré (32%) a une valeur de pH de -1. Dans l'air humide, le gaz HCl forme un brouillard de fines gouttelettes d'acide chlorhydrique.
L'acide chlorhydrique dilué est un bon conducteur d'électricité.
Réactions
L'acide chlorhydrique dissout la plupart des métaux à l'exception des métaux précieux tels que par ex. le tantale (germanium), le cuivre et le mercure (uniquement en présence d'oxygène) et l'argent pour former des chlorures et de l'hydrogène à moins d'être protégés par passivation.
Il est très bien adapté pour éliminer rapidement la rouille de l'acier, car les oxydes métalliques réagissent avec l'acide chlorhydrique pour former des chlorures et de l'eau :
Un mélange d'acide chlorhydrique et d'acide nitrique est appelé eau régale car il peut également dissoudre l'or, le "roi des métaux". En plus de l'effet oxydant du chlorure de nitrosyle et du chlore naissant, la réduction de la concentration effective en ions or par formation de complexes contribue également :
Utilisation
L'acide chlorhydrique est d'une grande importance dans l'industrie chimique en tant qu'acide inorganique. L'acide chlorhydrique est utilisé, par exemple, dans le traitement des minerais et du phosphate naturel. Il est utilisé dans le traitement à l'acide des puits de pétrole et de gaz et dans le traitement des métaux pour le décapage, la gravure et le brasage.
L'acide chlorhydrique est un réactif important dans l'analyse chimique. Il est capable de séparer un groupe de métaux des autres métaux par précipitation. Ceux-ci peuvent ensuite être analysés séparément (voir; groupe acide chlorhydrique). L'alcalimétrie est un autre domaine d'utilisation de l'acide chlorhydrique.
En tant qu'additif alimentaire, l'acide chlorhydrique porte la désignation E 507.
Importance biologique
Chez l'homme et les animaux, l'acide chlorhydrique est un composant du suc gastrique, où il provoque, entre autres, l'hydrolyse des graisses, mais sert également à tuer les germes avant qu'ils ne pénètrent dans le système digestif ultérieur.
Consignes de sécurité
Le contact avec la peau provoque des brûlures chimiques. Les vapeurs sont irritantes En cas de contact avec les yeux, laver immédiatement et abondamment avec de l'eau et consulter un spécialiste. En cas d'accident ou de malaise, consultez immédiatement un médecin.
Preuve
L'acide chlorhydrique se détecte d'une part par son caractère acide. De plus, l'anion chlorure est identifié dans une solution fortement diluée par précipitation au nitrate d'argent sous forme de chlorure d'argent :
Le précipité blanc qui en résulte se dissout dans de l'eau ammoniacale ou dans de l'acide chlorhydrique concentré avec formation d'un complexe :
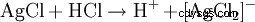
Si de l'acide chlorhydrique est chauffé en présence de dioxyde de manganèse, du chlore gazeux est produit :
La teneur en pourcentage d'acide chlorhydrique est déterminée par titrage à la soude caustique (→ acidimétrie, analyse volumétrique). Cette détermination, ainsi que celle des chlorures, peut être effectuée par photométrie à l'aide du sel de mercure de l'acide chloranilique. La teneur en acide chlorhydrique du suc gastrique est déterminée à l'aide du réactif de Günzburg.
Références
- ↑ Entrée sur l'acide chlorhydrique dans la base de données des substances GESTIS du BGIA, récupérée le 16 décembre 2007 (JavaScript requis)
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman :Manuel de chimie inorganique , 101e édition, p.460f., Gruyter 1995, ISBN 978-3-11-012641-9