| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| General | |||||||
| Nombre | Sulfato de Sodio | ||||||
| Otros nombres | sulfato de disodio, E 514, sal de Glauber (Na2 SO4 · 10H2 O) | ||||||
| Fórmula molecular | Na2 SO4 | ||||||
| Número CAS | 7757-82-6 | ||||||
| Breve descripción | cristales incoloros e inodoros | ||||||
| Propiedades | |||||||
| Masa molar | 142,04 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,70 g·cm | ||||||
| Punto de fusión | 884 °C | ||||||
| Punto de ebullición | 1689 °C | ||||||
| Solubilidad | bueno en agua:170 g/l, a 20 °C | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Sulfato de sodio (Na2 SO4 , nombre obsoleto sulfato de sodio ) es una sal de sodio del ácido sulfúrico y consta de dos cationes Na (Na) y el anión sulfato (SO4 ) juntos. El decahidrato (Na2 SO4 · 10H2 O) también se llama Glaubersalz en honor al químico Johann Rudolph Glauber También llamada Sal de Carlsbad , que se obtiene por evaporación del agua mineral de Karlovy Vary, se compone principalmente de sulfato de sodio decahidratado y se utiliza como laxante, como la sal de Glauber.
Historia
El sulfato de sodio fue producido y descrito alrededor de 1655 por el químico y farmacéutico Johann Rudolph Glauber. Él mismo llamó a la sal que descubrió Sal mirabilis y Mirábili .
Obtención y visualización
El sulfato de sodio rara vez se extrae de minerales naturales, ya que a menudo es un subproducto de las reacciones de la industria química en las que el ácido sulfúrico se neutraliza con sosa cáustica. Otra posibilidad de representación técnica es la reacción de sal gema (NaCl) con ácido sulfúrico para obtener ácido clorhídrico con sulfato de sodio como subproducto (a 800°C):
-
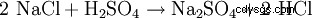
- El cloruro de sodio y el ácido sulfúrico reaccionan para formar sulfato de sodio y cloruro de hidrógeno.
El sulfato de sodio se puede producir en el laboratorio mediante las siguientes reacciones:
-

- El sodio y el ácido sulfúrico reaccionan para formar sulfato de sodio e hidrógeno.
-
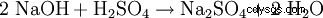
- El sulfato de sodio y el agua se producen durante la neutralización de la soda cáustica con ácido sulfúrico.
Propiedades
El sulfato de sodio anhidro se funde a 884 °C, es higroscópico y fácilmente soluble en agua cuando se calienta (calor de solución). Por el contrario, el decahidrato se disuelve bajo un fuerte enfriamiento, debido al llamado efecto de entropía. El sulfato de sodio decahidratado es un componente de muchas aguas minerales y se derrite lentamente en su propia agua cristalina a unos 32 °C. La sal anhidra se separa de esta solución, que está sobresaturada con sulfato de sodio anhidro.
Uso
El sulfato de sodio se utiliza en detergentes como relleno, en medicina como laxante, en la producción de pulpa (proceso de sulfato) y en las industrias del vidrio, textil y pintura. El sulfato de sodio anhidro recocido se utiliza en el laboratorio para secar disolventes orgánicos. Sulfato de sodio decahidratado (sal de Glauber ) se utiliza como laxante y material de almacenamiento de calor latente.
En tecnología alimentaria, se utiliza como agente reafirmante, regulador de la acidez y sustancia portadora. El sulfato de sodio y el hidrogenosulfato de sodio son aditivos alimentarios numerados E 514 en la UE sin límite máximo (quantum satis ) generalmente aprobado para alimentos.
Fuentes
- ↑ https://www.zusatzstoffe-online.de/zusatzstoffe/216.e514_natriumsulfate.html
