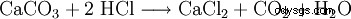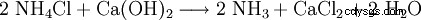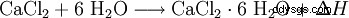| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Cloruro de calcio | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | CaCl2 | ||||||
| Número CAS | 10043-52-4 (anhidro) 10035-04-8 (dihidrato) 25094-02-4 (tetrahidrato) 07774-34-7 (hexahidrato) | ||||||
| Breve descripción | cristales higroscópicos incoloros e inodoros | ||||||
| Propiedades | |||||||
| Masa molar | 110,98 g mol (anhidro) 147,02 g mol (dihidrato) 182,04 g mol (tetrahidrato) 219,08 g mol (hexahidrato) | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,16 g cm (anhidro) 1,85 g cm (dihidrato) 1,71 g cm (hexahidrato) | ||||||
| Punto de fusión | 782 °C (anhidro) aprox. 176 °C (dihidrato) aprox. 35 °C (tetrahidrato) | ||||||
| Punto de ebullición | 1935 °C | ||||||
| Presión de vapor | 11hPa | ||||||
| Solubilidad |
fácilmente soluble en agua:740 g l (20 °C) | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
| Estructura cristalina ||Rutilo (distorsionado), octaédricocloruro de calcio (también cloruro de calcio ) es un cloruro del metal alcalinotérreo calcio con la fórmula molecular CaCl2 . El calcio tiene el estado de oxidación +2, el cloro tiene el estado de oxidación −1.
Historia
Alrededor de 1860, los químicos Robert Wilhelm Bunsen y Matthiessen lograron la primera preparación pura del elemento calcio a través de la electrólisis del cloruro de calcio.
Ocurrencias
El cloruro de calcio se encuentra en la naturaleza disuelto en salmueras.
Obtención y visualización
El cloruro de calcio está hecho de ácido clorhídrico y carbonato de calcio:
El calentamiento posterior a 260 °C proporciona la forma anhidra.
Técnicamente, el cloruro de calcio se obtiene como residuo de la producción de soda con el proceso Solvay, es decir, cuando se recupera el amoníaco del cloruro de amonio que se produce:
Propiedades
El cloruro de calcio es una sal. El calcio y el cloro existen como iones debido a la gran diferencia de electronegatividad. Por lo tanto, la unión tiene lugar a través de interacciones electrostáticas.
En su forma pura, el cloruro de calcio forma cristales incoloros y es altamente higroscópico cuando está anhidro. Absorbe fácilmente el agua de su entorno, formando un complejo de hidratos.
Reacciones
El cloruro de calcio reacciona con el agua para formar un complejo hexahidratado y desarrolla mucho calor (exotérmico, ΔH> 0):
Los cristales del hexahidrato se disuelven en su propia agua de cristalización a unos 30 °C. El agua ligada se libera nuevamente calentándola a alrededor de 200 °C. La disolución en agua, a diferencia del cloruro de calcio anhidro, conduce a un fuerte enfriamiento. Ambas formas de cloruro de calcio también son fácilmente solubles en etanol.
Uso
Debido a su higroscopia, el cloruro de calcio anhidro es un importante agente secante en el laboratorio, por ejemplo en el desecador, y en química técnica para una amplia variedad de gases y líquidos. Los campos de aplicación son el secado de espacios habitables, uso como anticongelante, en particular como anticongelante y acelerador de fraguado en hormigón, y como aglutinante de polvo (por ejemplo, en obras de construcción). En medicina, se utiliza para detener hemorragias y para tratar enfermedades por deficiencia de calcio, así como para tratar sabañones y alergias.
Se utiliza como agente reafirmante, potenciador del sabor y estabilizador (p. ej., en el tratamiento del agua potable, tratamiento de la superficie de la fruta). En la UE tiene el número E 509 como aditivo alimentario. aprobado.
El cloruro de calcio se utiliza para calentar bebidas listas para beber mediante la hidratación exotérmica al reaccionar con el agua. También se utiliza como sal para carreteras y para la producción de mezclas refrescantes (ver arriba ).
También se utiliza para coagular proteínas en tecnología alimentaria y se emplea en la fabricación de productos como el tofu o el caviar artificial.
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 de mayo 2007