| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| 2+ | |||||||
| General | |||||||
| Nombre | carbonato de amonio | ||||||
| Otros nombres | amonio carbonatado, sal de cuerno de ciervo | ||||||
| Fórmula molecular | (NH4 )2 CO3 | ||||||
| Número CAS | 10361-29-2 | ||||||
| Breve descripción | sólido incoloro | ||||||
| Propiedades | |||||||
| Masa molar | 96,09 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 1,6 gcm | ||||||
| Punto de fusión | se descompone a 58 °C | ||||||
| Punto de ebullición | decae antes | ||||||
| Presión de vapor | 0,69 Pa (20 °C) | ||||||
| Solubilidad | bueno en agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Carbonato de amonio , (NH4 )2 CO3 H2 O, forma cristales cúbicos incoloros, solubles en agua con peso molecular Mr de 114.10. Se descompone completamente en amoníaco, dióxido de carbono y agua a 58 °C.
Propiedades
La sal forma un polvo incoloro con un ligero olor a amoníaco. Tiene una densidad de alrededor de 1,6 g cm (a 20 °C) y una alta solubilidad en agua de aproximadamente 220 g/L. La solución reacciona débilmente alcalina, se establece un equilibrio entre el amoníaco NH3 , iones de amonio NH4 , iones de carbonato CO3 , iones de hidrogenocarbonato HCO3 y dióxido de carbono CO2 a.
La sal reacciona así con agua y ácido carbónico para formar carbonato de hidrógeno e iones de hidróxido. Por lo tanto, una solución acuosa de carbonato de amonio solo es estable en un entorno neutro y débilmente básico:el gas de dióxido de carbono se escapa en los ácidos y el gas de amoníaco en los álcalis concentrados.
Síntesis
El carbonato de amonio se puede preparar haciendo reaccionar dióxido de carbono con amoníaco en una solución acuosa.
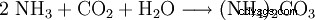
Otra forma de mostrar esto es calentando carbonato de calcio junto con sulfato de amonio.

Con este último método, el bicarbonato de amonio y el carbamato de amonio se subliman además del carbonato de amonio deseado, dejando el sulfato de calcio como un sólido.
Uso
El carbonato de amonio se utiliza en la síntesis de heterociclos y como aditivo en reveladores fotográficos. También se utiliza en tinturas, como generador de dióxido de carbono en extintores y como sal aromática.
También se utiliza como agente leudante (también conocido como sal de cuerno de ciervo). En la UE se numera E 503i como aditivo alimentario. aprobado.
El carbonato de amonio se usa a menudo en química inorgánica para un análisis cualitativo con el fin de precipitar los cationes de metales alcalinotérreos de bario, estroncio y calcio de una muestra desconocida como grupo, separarlos e identificarlos con la ayuda de reacciones de detección.

