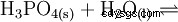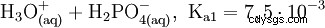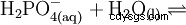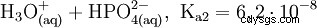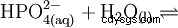| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | ácido fosfórico | ||||||
| Otros nombres | ácido ortofosfórico | ||||||
| Fórmula molecular | H3 PO4 | ||||||
| Número CAS | 7664-38-2 | ||||||
| Breve descripción | sólido incoloro e inodoro | ||||||
| Propiedades | |||||||
| Masa molar | 98,00 g mol | ||||||
| Estado de la materia | sólido (a menudo líquido, ya que una masa fundida sobreenfriada se puede almacenar durante mucho tiempo) | ||||||
| Densidad | 1,834 g·cm (18 °C) | ||||||
| Punto de fusión | 42,35 °C | ||||||
| Punto de ebullición | Descomposición:213 °C (deshidratación) | ||||||
| Presión de vapor | 3,8 Pa (20 °C) | ||||||
| valor pKa | 2.16; 7.21; 12.32 | ||||||
| Solubilidad | completamente miscible con agua, fácilmente soluble en alcohol | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | 2 mg m (fracción de aerosol respirable) | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Los normales o orto- Ácido fosfórico es el ácido principal del fósforo. La sustancia anhidra es altamente higroscópica. Es un ácido triprótico y reacciona como un ácido moderadamente fuerte con respecto a la primera desprotonación. Los condensados ácido difosfórico, ácidos meta- y polifosfóricos se derivan de él. Como aditivo alimentario, el ácido fosfórico figura como E 338 declarado.
Obtención y visualización
El ácido fosfórico se puede obtener a partir de fosfato de roca (principalmente apatita, Ca5 (PO4 )3 (F, OH, Cl)) con ácido sulfúrico, ácido clorhídrico o ácido nítrico. CaSO4 se forman como subproductos (anhidrita, yeso) y H2 [SiF6 ] (ácido hexafluorosilícico). Alternativamente, el ácido fosfórico se puede obtener quemando fósforo elemental para formar pentóxido de fósforo, P4 O10 , y posterior hidrólisis (el llamado ácido fosfórico térmico).
Propiedades
El ácido fosfórico es un ácido tribásico que puede donar su hidrógeno como protones solvatados en tres etapas para formar aniones dihidrógeno fosfato, hidrógeno fosfato y fosfato. Los valores pKs asociados son pKs1 =2,161; pKs2 =7,207 y pKs3 =12.325.
Uso
El ácido fosfórico se utiliza como materia prima para la producción de fertilizantes que contienen fosfato (>90 % de la producción en EE. UU.), detergentes, desoxidantes o convertidores de óxido y para la pasivación del hierro y el zinc para protegerlos contra la corrosión. El cemento de fosfato de zinc se utiliza en odontología.
Si bien tiene un efecto cáustico en altas concentraciones, se utiliza diluido en la industria alimentaria como conservante, acidulante (especialmente en bebidas de cola) y como regulador de la acidez (E 338), ya que el ácido fosfórico no es tóxico para el organismo humano. , además de su efecto cáustico. También es adecuado para preparar soluciones tampón (varios "tampones de fosfato").
Importancia biológica
Los ésteres de ácido fosfórico juegan un papel central en el metabolismo, especialmente como transportadores de energía y grupos (ver, por ejemplo, ATP y GTP). Son parte integral del ADN, ARN, muchas coenzimas, etc.
Prueba
El ácido fosfórico y los fosfatos solubles se pueden separar por precipitación con molibdato de amonio para formar fosfato de molibdato de amonio amarillo, o por precipitación con iones de magnesio en una solución amoniacal para formar MgNH4. PO4 probar.
Fuentes
- ↑ RÖMPP en línea, Thieme 2007
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 3 de marzo 2007
- ↑ ESIS-Sistema Europeo de Información sobre Sustancias Químicas
- otros compuestos de oxígeno del fósforo