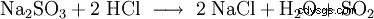| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | Dióxido de azufre | ||||||
| Otros nombres | Óxido de azufre (IV), anhídrido sulfuroso | ||||||
| Fórmula molecular | SO2 | ||||||
| Número CAS | 7446-09-5 | ||||||
| Breve descripción | gas incoloro, picante y tóxico | ||||||
| Propiedades | |||||||
| Masa molar | 64,06 g mol | ||||||
| Estado de la materia | gaseoso | ||||||
| Densidad | 2,73 kg·m (1 bar, 15 °C) | ||||||
| Punto de fusión | −75 °C | ||||||
| Punto de ebullición | −10 °C | ||||||
| Presión de vapor | 3,3 bares (21 °C) | ||||||
| Solubilidad | bueno (112 g/l ) en agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | 1,3 mg m | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Dióxido de azufre , SO2 , es el anhídrido del ácido sulfuroso H2 SO3 . El dióxido de azufre es un gas tóxico e incoloro con un olor acre y un sabor agrio. Se produce principalmente cuando se queman combustibles fósiles que contienen azufre, como el carbón o los derivados del petróleo, que contienen hasta un 4 por ciento de azufre. Como resultado, contribuye significativamente a la contaminación del aire, es la causa de la lluvia ácida, donde el dióxido de azufre se oxida primero con oxígeno para formar trióxido de azufre y luego con agua para formar ácido sulfúrico (H2 SO4 ) está implementado. Para evitar esto, existen varios procesos para la desulfuración de gases de combustión.
Fabricación
- quemando azufre o sulfuro de hidrógeno
- tostando minerales de sulfuro
p.ej. B. de pirita:
-

- El disulfuro de hierro(II) y el oxígeno reaccionan para formar óxido de hierro(III) y dióxido de azufre.
- de sulfitos por ácidos más fuertes
Propiedades
| Número E | 220 |
| temperatura crítica | 157,5 °C |
| presión crítica | 7,9 bares |
Una fórmula límite mesomérica del dióxido de azufre es la siguiente:
En términos generales:
El dióxido de azufre líquido disuelve numerosas sustancias y, por lo tanto, se ha establecido como un solvente valioso.
Uso
El dióxido de azufre se encuentra en la industria alimentaria con el nombre E 220 se utiliza como conservante y antioxidante, especialmente para frutos secos, platos de patatas, zumos de frutas, mermeladas y vinos. También se utiliza para producir cloruro de sulfurilo SO2 Cl2 y cloruro de tionilo SOCl2 .
Además, el dióxido de azufre es un material de partida importante para la producción de trióxido de azufre, para luego producir ácido sulfúrico concentrado, p. B. con el método de contacto.
El dióxido de azufre también se utiliza en la fabricación de muchos productos químicos, medicamentos y tintes, y en el blanqueo de papel y textiles.
Contaminación
En altas concentraciones, el SO2 daña a humanos, animales y plantas. Los productos de oxidación dan como resultado una "lluvia ácida" que pone en peligro ecosistemas sensibles como bosques y lagos y ataca edificios y materiales.
Las emisiones totales de SO2 se han reducido considerablemente en los países industrializados desarrollados durante las últimas dos décadas mediante el uso de combustibles y combustibles con bajo contenido de azufre o sin azufre.
Instrucciones de seguridad
Una concentración de dióxido de azufre por encima del valor MAK puede causar dolores de cabeza, náuseas y somnolencia en los seres humanos. En concentraciones más altas, el gas daña gravemente los bronquios y los pulmones o incluso los ácidos nucleicos, los portadores de las propiedades hereditarias.
Fuentes
- ↑ Hoja de datos de seguridad del material (Praxair)
- ↑ Base de datos de sustancias peligrosas de BGIA Gestis
- ↑ Holleman-Wiberg:Libro de texto de química inorgánica 102ª edición, de Gruyter, Berlín, 2007.