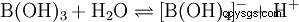| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | kwas borowy | ||||||
| Inne nazwy | Borofax | ||||||
| Formuła molekularna | H3 BO3 | ||||||
| Numer CAS | 10043-35-3 | ||||||
| Krótki opis | biały proszek | ||||||
| Właściwości | |||||||
| Masa molowa | 61,83 g/mol | ||||||
| Stan materii | naprawiono | ||||||
| Gęstość | 1,44 g/cm | ||||||
| Temperatura topnienia | Rozkłada się w temperaturze 185°C | ||||||
| Temperatura wrzenia | nie istnieje | ||||||
| Ciśnienie pary | 2,7 hPa (20 °C) | ||||||
| Rozpuszczalność | 50 g/l w wodzie | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | brak | ||||||
| LD50 | 2660 mg/kg | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
kwas borowy (też:kwas ortoborowy ), H3 BO3 , jest najprostszym kwasem tlenowym boru, jego sole nazywane są boranami. (Wcześniej nazywany również wodorotlenkiem boru)
Właściwości
Czysty kwas borowy tworzy łuskowate, bezbarwne, błyszczące kryształy o temperaturze topnienia 171°C. Początkowo trudno go rozpuścić w wodzie, ale proces ten przyspiesza wraz ze wzrostem stężenia. Roztwór reaguje słabo kwaśno. Z metanolem – nawet bez stężonego kwasu siarkowego – powstaje lotny ester metylowy kwasu borowego, który pali się zielonym płomieniem i służy do jakościowego wykrywania boru.
Po podgrzaniu kwasu ortoborowego następuje oddzielenie wody i powstanie kwasu metaborowego HBO2, który występuje w kilku modyfikacjach i wreszcie, z dalszą eliminacją wody, trójtlenek diboru B2 O3 .
Pomimo swoich trzech atomów wodoru, kwas borowy reaguje w wodzie jak kwas monoprotonowy, dając jon tetrahydroksoboranowy B(OH)4 . Tutaj nie zachowuje się jak kwas Brønsteda jako donor protonów, ale jak kwas Lewisa jako akceptor wodorotlenku:
Kwas borowy jest bardzo słabym kwasem (pKs =9,25). W reakcji z alkoholami wielowodorotlenowymi, takimi jak. B. mannitol, moc kwasu można znacznie zwiększyć. Wynika to z przesunięcia równowagi w prawo w kierunku pochodnej tetraoksoboranowej w wyniku estryfikacji:
Reakcja ta jest stosowana do miareczkowania alkalicznego kwasu borowego, a także do oznaczania azotu metodą Kjeldahla.W małych ilościach nie jest toksyczna. ale borany są bardzo toksyczne.
Wystąpienie i ekstrakcja
Wolny kwas borowy znajduje się w źródłach pary (fumarole) w środkowych Włoszech w Toskanii.Kwas można uzyskać z tych źródeł poprzez odparowanie go w błyszczących płytkach krwi. Kwas borowy występuje również w Toskanii jako sassolina mineralna. Jednak duże znaczenie mają sole alkaliczne i ziem alkalicznych, takie jak mineralny kernit Na2 B4 O7 · 4H2 O. Podobnym, rzadszym minerałem jest boraks, który zawiera 8 lub 10 równoważników wody krystalicznej. Obecnie jednak pozyskuje się go głównie z kernitu. Traktując boraks kwasem solnym lub siarkowym, kwas borowy B(OH)3 zwolnienie.
Wykorzystanie
Wodny roztwór („woda wiertnicza”) służy jako łagodny środek dezynfekujący i jest również zatwierdzony jako środek konserwujący E284. Kwas borowy jest półproduktem stosowanym w produkcji szkła borokrzemianowego, porcelany, emalii, a także znajduje się w środkach zmniejszających palność i zaprawach. Roczna światowa produkcja kwasu borowego wynosi ponad 200 kiloton.
Innym zastosowaniem kwasu borowego są elektrownie jądrowe z ciśnieniowymi reaktorami wodnymi. Ze względu na wysoki współczynnik absorpcji neutronów termicznych izotopu B-10, który w naturalnym borze występuje w 20%, stosuje się tam kwas borowy do kontrolowania mnożnika k, a tym samym mocy reaktora.
Ponadto kwas borowy służy do obliczania CO2 -Wynagrodzenie używane na ziemi w czasach starożytnych. W środowisku kwaśnym więcej boru jest wbudowywane w kwas borowy. Kiedy pH zmienia się na zasadowe, kwas borowy przekształca się w boran, sól kwasu borowego. Ponieważ otwornice (zarówno kopalne, jak i niedawne organizmy jednokomórkowe) potrzebują boranu do budowy swojej skorupy, zależność tę można wykorzystać do określenia, jakie pH było obecne na tym obszarze w jakim momencie w historii Ziemi. Ponieważ muszle takich pierwotniaków, małże itp. stanowią główną część osadów morskich, rdzenie osadów można po prostu pobrać stamtąd i zbadać w laboratorium pod kątem dwóch izotopów boru. Takie wyniki dobrze korelowały z pęcherzykami powietrza uwięzionymi w rdzeniach lodowych.
Kwas borowy w połączeniu z metanolem daje zielony kolor płomienia; w połączeniu z innymi alkanolami granica zielonego płomienia. Ta właściwość jest często wykorzystywana podczas pokazów ognia, na przykład do kolorowania kijów z płomieniami, pois lub misek z ogniem.
Źródła
- ↑ Karta charakterystyki (Merck)