| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namn, symbol, Ordnungszahl | Silber, Ag, 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Övergångsmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp, Periode, Block | 11, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | weißglänzend, metallisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 1 · 10 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 107 8682 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 160 (165) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radie | 153 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 172 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr]4d5s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen för energinivå | 2, 8, 18, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,3 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 731,0 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 2070 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 3361 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikalisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisk flächenzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 10,49 g/cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | diamagnetisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1234,93 K (961,78 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2435 K (2162 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 10,27 · 10 m/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 250,58 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzvärme | 11,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 0,34 Pa vid 1234 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | ~3600 (lång.), ~1600 (översättning) m/s vid 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 232 J/(kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 62 · 10 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 429 W/(m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +1 , +2, +3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid (Basizität) | Ag2 O, Ag2 O2 (ofta falsch AgO), Ag3 O4 , Ag2 O3 (amfoter) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,7996 V (Ag + e → Ag) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,93 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahrstoffkennzeichnung | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (Kein Gefahrensymbol) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R- och S-Sätze | R:keine R-Sätze | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S:keine S-Sätze | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich and gebräuchlich, were SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Silber är ett kemiskt element från der elften Gruppe (Kupfergruppe) des Periodensystems. Das Elementsymbol Ag leitet sich vom lateinischen Wort a rg entum für „Silber“ ab. Silber ist ein Edelmetall und gehört zu den Münzmetallen. Es ist ein weiches, gut verformbares (duktiles) Schwermetall mit der größten elektrischen Leitfähigkeit aller Elemente und der größten thermischen Leitfähigkeit aller Metalle, lediglich Supraflüssigkeiten und Diamanten show eine bessere thermische Leitfähigkeit auf.
Etymologi
Das Wort "Silber" leitet sich über ahd. silabar aus der germanischen Wurzel *silubra- ab. Aus dieser Wurzel leiten sich auch die Wörter der baltischen und slawischen Sprachen wie z. B. das russische serebro (серебро) sowie das baskische Lehnwort zilar ab. Letztlich ist es aber wohl nicht germanischen Ursprungs, sondern aus einer orientalischen Sprache entlehnt. Die Philologie des 19. Jahrhunderts brachte eine Vielzahl von Theorien über den Ursprung des Wortes hervor. Der bis heute häufig zu lesende Zusammenhang mit dem in Homers Ilias beschriebenen sagenhaften Land Alybe (Αλυβη) blev 1870 av Victor Hehn hergestellt, måste Spekulation bleiben. In den meisten anderen indoeuropäischen Sprachen geht das Wort für „Silber“ auf die genuin indogermanische Wurzel *arg zurück, så gr. αργυρος und lat. argentum . Das Land Argentinien verdankt dem Silber seinen Namen.
Historia
Silber wird von Menschen etwa seit dem 5. Jahrtausend v. Chr. verarbeitet. Es wurde zum Beispiel von den Assyrern, den Goten, den Griechen, den Römern, den Ägyptern och den Germanen utnyttjat. Zeitweise galt es als wertvoller als Gold. Das Silber stammte meistens aus den Minen i Laurion, die etwa 50 Kilometer südlich von Athen lagen. Bei den alten Ägyptern war Silber als Mondmetall bekannt.
Im Mittelalter wurden i Deutschland Silbererzvorkommen im Harz (Goslar), i Sachsen (Freiberg und im übrigen Erzgebirge), im Südschwarzwald (Schauinsland, Belchen, Münstertal, Feldberg), Böhmen (Kutná Hora) und der Slowakei upptäckt.
Größter Silberproduzent im Mittelalter war Schwaz. Bis zu 80% des damaligen Silbers kam aus den Stollen der Schwazer Knappen.
Später brachten die Spanier große Mengen von Silber aus Amerika, unter anderem aus der sagenumwobenen Mine von Potosí, nach Europa. Auch Japan war im 16. Jahrhundert Silberexporteur. Durch das gestiegene Angebot sjönk der Silberwert in der alten Welt.
Efter 1870 vorwiegend Gold som valutorsmetall begagnade, varlor das Silber seine wirtschaftliche Bedeutung immer mehr. Das Wertverhältnis sank von 1:14 einige Zeit lang auf 1:100, später stieg es wieder etwas an. Heute ligger es auf ungefähr 1:60. Das Angebot an Silber ist von der Verbrauchs- und Produktionsentwicklung anderer Metalle abhängig.
Mitte des 19. Jahrhunderts word rostfreier Stahl entwickelt, der dann aufgrund seiner Gebrauchsfreundlichkeit och des attraktiven Preises nach dem Ersten Weltkrieg in die Einsatzbereiche des Silbers vordrang, etwa Servierplatten, Bestecke, Leuchter and Küchengerät. Gegenläufig dazu hat sich der Bereich Fotografie und Fotochemie unter Verwendung der Silbersalze during des ganzen 20. Jahrhunderts breit entwickelt, verliert aber seit Ende der 90er Jahre im Zuge der Umstellung auf die digital Abbildungstechnik wieder an Bedeutung.
Trotz dieser Entwicklung ist die Silbernachfrage weltweit steigend und wird aktuell (2006) noch dadurch gedeckt, dass einige Staaten, zum Beispiel die Volksrepublik China, zur Zeit ihre Silberreserven veräußern. Da der Bestand zur Neige geht, wird Silber als unterbewertet angesehen.
Vorkommen
Silber wird in der Natur gediegen gefunden. Es tritt dabei meist in Form von Körnern oder als drahtig verästeltes Geflecht (Dendrit) in hydrothermal gebildeten Erzgängen auf. Neben gediegenem Silber hittat man es vor allem i sulfidischen Mineralien. Zu den wichtigsten sulfidischen Silbererzen zählen Silberglanz (Argentit) Ag2 S und Kupfersilberglanz (Stromeyerit) CuAgS. Silber findet man seltener auch als Silberhornerz (Chlorargyrit) AgCl und als Silberantimonglanz (Miargyrit) AgSbS2 . Die wichtigsten Silbervorkommen befinden sich i Nordamerika (Mexiko, den USA och Kanada) och i Sydamerika (Peru, Bolivien).
Neben diesen Silbererzen findt man noch so genannte silberhaltige Erze, die meist nur geringe Mengen Silber (0,01–1 %) enthalten. Dies sind häufig Bleiglanz (PbS) und Kupferkies (CuFeS2 ). Aus diesem Grund wird Silber häufig als Nebenprodukt bei der Blei- oder Kupferherstellung vunnen.
Silber ist ein seltenes Element, es kommt mit etwa 0,079 ppm (entsprechend 0,0000079 Prozent) in der Erdkruste vor. Es ist allerdings ca. 20 mal häufiger als Gold.
Förderung
Das meiste Silber wird aber aus Silbererzen won, die oft zusammen mit Blei-, Kupfer- och Zinkerzen as Sulfide or Oxide vorkommen. Wichtige Fundorte von gediegenem Silber waren:Freiberg/Erzgebirge; Kongsberg/Norge (dort auch große Kristalle); S:t Andreasberg/Harz; Keweenaw-Halbinsel/USA (dort mit gediegenem Kupfer as "halfbreed"); Batopilas/Mexiko; Mansfelder Kupferschiefer-Revier (Eisleben, Sangerhausen; meist Silberbleche; auch als Versteinerungsmaterial von Fossilien).
Zwischen dem Beginn des 20. Jahrhunderts und dem Ende des zweiten Weltkrieges hat die jährlich geförderte Silbermenge zwar fluktuiert, ist aber ziemlich konstant geblieben. Nach Kriegsende hat sich die Fördermenge bis heute mehr als verdoppelt.
Laut einer Studie des Rheinisch-Westfälisches Instituts für Wirtschaftsforschung, des Fraunhofer-Instituts für System- und Innovationsforschung sowie der Bundesanstalt für Geowissenschaften und Rohstoffe beträgt die Reichweite der Silberressourcen nur noch 29 Jahre. Somit ist mit einer Verknappung von Silber in the nexten Jahrzehnten zu rechnen.
| Ring | Land | Fördermengen (i t) | Ringde | Land | Fördermengen (i t) |
|---|---|---|---|---|---|
| 1 | Mexiko | 2955 | 11 | Turkiet | 795 |
| 2 | Peru | 2921 | 12 | Bolivien | 455 |
| 3 | Australien | 2056 | 13 | Schweden | 300 |
| 4 | Polen | 1561 | 14 | Marokko | 240 |
| 5 | Kanada | 1255 | 15 | Indonesiska | 166 |
| 6 | USA | 1239 | 16 | Argentinien | 134 |
| 7 | Kina | 1200 | 17 | Sydafrika | 130 |
| 8 | Chile | 1100 | 18 | Japan | 82 |
| 9 | Russische Föd. | 810 | 19 | Griechenland | 79 |
| 10 | Kasachstan | 800 | 20 | Papua-Neuguinea | 60 |
Wie bei den andra Edelmetallen spielt die Wiederaufarbeitung silberhaltiger Materialien im Rahmen des Recyclings, beispielsweise von Fotopapieren, Röntgenfilmen, Entwickler- och Fixierbädern, Elektronikmaterialien och Batterien eine wichtige Rolle.
Gewinnung och Darstellung
Gewinnung aus Silbererzen
20 % des Silbers wird aus Silbererzen vunnen. Aus diesen wird das Silber meist durch Cyanidlaugerei mit Hilfe einer 0,1 %igen Natriumcyanid-Lösung herausgelöst. Dazu wird das Erz zunächst fein zu einem Schlamm zerkleinert. Anschließend wird die Natriumcyanid-Lösung dazugegeben. Dabei ist eine gute Belüftung wichtig, da für das Verfahren Sauerstoff benötigt wird.
Bei der Zugabe von Natriumcyanid gehen sowohl elementares Silber wie auch Silbererze (Ag2 S, AgCl) som Dicyanoargentat(I) [Ag(CN)2 ] i Lösung:
-
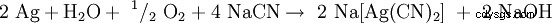 ,
, -
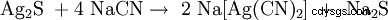 ,
, -
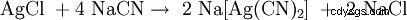 .
.
-
Da die Reaktion von Natriumcyanid mit Silbersulfid in einem Gleichgewicht steht, muss das Natriumsulfid antingen durch Oxidation mit Sauerstoff or durch Fällung (z. B. as Bleisulfid) entfernt werden. Anschließend fällt man das edlere Silber – ähnlich wie bei der Goldgewinnung – mit Zink aus:
-
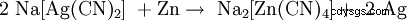 .
.
-
Das ausgefallene Rohsilber wird abgefiltert und weiter gereinigt (s. Raffination).
Gewinnung aus Bleierzen
Bei der Gewinnung von Bleierzen, z. B. aus Bleiglanz, entsteht nach dem Rösten und Reduzieren das sogenannte Werkblei (genauere Informationen zur Bleigewinnung siehe Blei). Dieses enthält meist noch einen Anteil Silber (zwischen 0,01 och 1 %). Im nächsten Schritt wird nun das Edelmetall entfernt und so dieses wertvolle Nebenprodukt gewonnen.
Zur Gewinnung muss zunächst das Silber vom größten Teil des Bleis getrennt werden. Dies geschieht durch das Verfahren des Parkesierens (nach A. Parkes, der dieses Verfahren 1842 erfand). Das Verfahren beruht auf der unterschiedlichen Löslichkeit von Silber und Blei i Zink. Temperaturen är upp till 400 °C och Blei (flüssig) och Zink (fest) praktiskt inte mischbar. Zunächst wird bei Temperaturer>400 °C till geschmolzen Blei Zink gegeben. Danach wird die Mischung abgekühlt. Da Silber im geschmolzenen Zink leicht löslich ist, geht es in die Zinkphase über. Anschließend erstarrt die Zinkschmelze as so calleder Zinkschaum (Zink-Silber-Mischkristalle). Dadurch kann das Silber vom größten Teil des Bleis getrennt werden. Dieser Zinkschaum wird auch als Armblei bezeichnet. Er wird anschließend bis zum Schmelzpunkt des Bleis (327 °C) erhitzt, so dass ein Teil des Bleis schmilzt und entfernt werden kann. Danach wird die verbliebene Zink-Blei-Silber-Schmelze bis zum Siedepunkt des Zinks (908 °C) erhitzt und das Zink abdestilliert. Das so wone Produkt wird Reichblei genannt und enthält ca. 8–12 % silber.
Um das Silber anzureichern, wird nun die sogenannte Treibarbeit durchgeführt. Dazu wird das Reichblei in einem Ofen geschmolzen. Dann wird ein Luftstrom durch die Schmelze geleitet. Dabei wird das Blei zu Bleioxid oxidiert, das edle Silber bleibt hingegen unverändert. Das Bleioxid wird laufend abgeleitet und so nach und nach das Blei entfernt. Das so wone Rohsilber hat einen Gehalt von etwa 95 %.
Gewinnung aus Kupfererzen
Silber ist auch i Kupfererzen enthalten. Bei der Kupferherstellung fällt das Silber – neben anderen Edelmetallen – im so genannten Anodenschlamm an. Dieser wird zunächst mit Schwefelsäure und Luft vom Großteil des noch vorhandenen Kupfers befreit. Anschließend wird är im Ofen oxidierend geschmolzen, wobei enthaltene unedle Metalle in die Schlacke gehen und entfernt werden können.
Raffinering
Rohsilber wird auf elektrolytischem Weg im sogenannten Möbius-Verfahren gereinigt. Dazu wird das Rohsilber als Anode in eine Elektrolysezelle geschaltet. Als Kathhode dient ein Feinsilberblech, als Elektrolyt salpetersaure Silbernitratlösung.
Das Verfahren entspricht der elektrolytischen Reinigung des Kupfers. While der Elektrolyse werden Silber und alle unedleren Bestandteile des Rohsilbers (beispielsweise Kupfer oder Blei) oxidiert und gehen in Lösung. Edlere Anteile som Gold och Platin kan inte oxideras och falla under elektroden. Dort bilden sie den Anodenschlamm, der en viktig Quelle für Gold och andra Edelmetalle ist. An der Kathhode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber.
Egenskaper
Fysikaliska egenskaper
Silber ist ein weißglänzendes Edelmetall. Das Metall kristalliserat im kubischen-flächenzentrierten Kristallsystem. Under normala temperaturer är temperatur 961 °C och temperatur 2212 °C. Silbermössa avsedd för 700 °C, även om den är festen, en deutlichen Dampfdruck. Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt en Dichte av 10,49 g/cm³ (vid 20 °C) och har alla Edelmetalle till den Schwermetallen.
Silber hatt einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 % des sichtbaren Lichtes. Som "weißestes" aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln benutzt. Strichfarbe ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das Reflexionsspektrum zeigt im nahen UV eine ausgeprägte Plasmakante.
Silber leitet von allen Metallen Wärme und Elektrizität am besten. Wegen seiner Dehnbarkeit und Weichheit (Mohshärte von 2,5) lässt es sich zu feinsten, blaugrün durchschimmernden Folien von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge Dräh 1 g 0,1 ) ausziehen.
Chemische Eigenschaften
Silber är en Edelmetall med en normalpotential av +0,7991 V. Aus diesem Grund är relativ reaktionssträge. Es reagiert auch bei höherer Temperaturen nicht mit dem Sauerstoff der Luft. Da in der Luft spurenweise Schwefelwasserstoff H2 S enthalten ist, laufen Silberoberflächen allerdings mit der Zeit schwarz an, da Schwefelwasserstoff das elementare Silber zu Silbersulfid (Ag2 S) oxiderat:
-
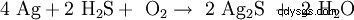 .
.
Licht, höhere Temperaturen, Feuchtigkeit, Schwefelspuren och Sauerstoff beschleunigen diesen Prozess. Allerdings gibt es auch Zweifel an dieser Reaktion, da Schwefelwasserstoff in der Luft normalte fast überhaupt nicht vorkommt.
Silber löst sich nur in oxidierenden Säuren, wie beispielsweise Salpetersäure, in nichtoxidierenden Säuren wie Salzsäure ist es nicht löslich. In konzentrierter Schwefel- und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch Silbernitrat und -sulfat passiviert ist. Silber löst sich i Cyanid-Lösungen bei Anwesenheit von Sauerstoff, da durch die Bildung eines sehr stabilen Silbercyanid-Komplexes das elektrochemische Potential stark verschoben ist. Silber är stabil gegen Schmelzen von Natriumhydroxid och andra Alkalihydroxide. Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel.
Användning
Användning som Edelmetall
Die früher wichtigste Verwendung war die Herstellung von Silbermünzen als Zahlungsmittel. Für Münzen blev in der Antike und im Mittelalter nur Silber, Gold und Kupfer bzw. Verwendt brons. Der Münzwert entsprach weitgehend dem Metallwert (Kurantmünze). In Deutschland waren bis 1871 Silbermünzen (Taler) vorherrschend, die Währung war durch Silber gedeckt (Silberstandard). Nach 1871 wurde der Silber- durch den Goldstandard abgelöst. Der Grund für die Verwendung dieser Edelmetalle war die geringe Reaktivität und damit hohe Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht (Scheidemünze). Silber wird als Münzmetall heute meist nur noch für Gedenk- und Sondermünzen verwendet.
Silber ist neben Gold und Edelsteinen (z. B. Diamanten) ett wichtiges Material für die Herstellung von Schmuck. Silber wird seit Jahrhunderten für erlesene und wertbeständige Essbestecke, Tafelsilber und Kirchengeräte verwendet. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des Feingehaltstempels abgelesen werden.
Silbermedaillen werden bei vielen Sportwettkämpfen, z. B. bei den Olympischen Spielen, als Zeichen für das Erreichen des zweiten Platzes verliehen. Dies kommt daher, dass Silber traditionellt nach Gold als nästa edleres Metall gilt. Allerding wird die Goldmedaille aus 92,5% Silber hergestellt and mit 6g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig mit „silbernes …“ bezeichnet. Beispiele sind Silberner Bär, Silberner Griffel, Silberner Schuh och Silbernes Lorbeerblatt.
Sehr begehrt ist es auch bei Musikinstrumenten, da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z. B. bei der Querflöte das empfindliche Holz ersetzt.
Silber besitzt die höchste elektrische Leitfähigkeit aller Metalle, eine hohe Wärmeleitfähigkeit und eine ausgeprägte optische Reflexionsfähigkeit. Dadurch ist es für Anwendungen in Elektrik, Elektronik und Optik prädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen Versilberung von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet.
Die Schwärzung der Silberhalogenide infolge ihres Zerfalls durch Licht wird beim Fotopapper genutzt och bilden sedan etwa 1850 die Grundlage der Fotografie.
Silberlegierungen (mit Kupfer, Zink, Zinn, Nickel, Indium usw.) were in der Elektrotechnik und Löttechnik as Lotlegierungen (sogenanntes Hartlöten), Kontaktmaterialien and Leitmaterial verwendet. Silberlegierungen blev aber auch in der Dentaltechnik och im dekorativen Bereich verwendet.
Silber wird als Lebensmittelfarbstoff E 174 auch im Speisenbereich verwendet, zum Beispiel für Überzüge von Süßwaren wie etwa Pralinen und in Likören. Silbersalze färben Glas und Emaille gelb.
Silbergeschirre und Geräte geben beim Gebrauch immer etwas Silber mit an die Speisen und Getränke ab, was sich in dem unangenehmen Metallgeschmack bemerkbar macht. Um dies zu unterbinden und um die Reinigung zu vereinfachen, werden silberne Trinkgefäße inom vergoldet.
Silber in antibakteriellen Anwendungen
In neuerer Zeit wurden Werkstoffe oder Beschichtungsverfahren entwickelt, die sich die antibakterielle Wirkung von Silber zunutze machen. Mit bestimmten Verfahren wird in der Regel nanoskaliges Silber in Werkstoffe eingebettet. Das eingebettete Silber gibt kontinuierlich Silberionen ab und wirkt dadurch antibakteriell. Beispiele für solche Anwendungen sind:
- Silberfäden eller Silberionen hemmen in der antimikrobiellen Ausrüstung von Textilien das Wachstum von Bakterien auf der Haut und verhindern damit unangenehme Gerüche.
- Einarbeitung zur Erzielung dermatologischer Effekte, z. B. bei Neurodermit
- Beschichtung von Oberflächen, z. B. i Kühlschränken, auf Küchenmöbeln, Lichtschaltern und anderen Gegenständen
- Kunststoffe zur Anwendung in der Medizintechnik
- Antibakterielle Emaillierungen und Keramiken
Silberlegierungen
Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold , Kupfer oder Palladium (ein Palladiumgehalt von 20 bis 30 % macht das Silber anlaufbeständig). I begränsningen är Umfang lässt sich Silber mit Chrom, Mangan eller Nickel legieren. Mit Cobalt oder Eisen läßt es sich nicht legieren. Legieren erhöht zumeist die Härte des Silbers.
Wichtige Silberlegierungen
Die wichtigsten Silberlegierungen sind heute Kupfer-Silber-Legierungen. Sie werden meist nach ihrem Feingehalt an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 och 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung Pfund Sterling as Sterlingsilber bezeichnet. Es ist die wichtigste Silberlegierung und wird u. a. zur Herstellung von Münzen, Schmuck och Besteck verwendet.
Im Hinblick auf den Export were heute Korpuswaren vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten gelötet werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von bei0spiel5sweise/100. Eine neuartige Legierung aus England är Argentium Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke och Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkufsfördernde, strahlendweiße Silberfarbe och en stark reducertes Anlaufen der Waren erreicht.
Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das Tulasilber, eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch vergoldet, man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann Vermeil.
Neusilber är dagen kein Silber, sondern eine silberähnliche, weiße, unedle Metalllegierung aus Kupfer, Nickel und Zink. Als "Tibetsilber" wird schließlich im Handel eine Legierung mit nur geringem (250 Tausendstel) Silberanteil bezeichnet.
Anslutningar
Silber kommt in chemischen Verbindungen hauptsächlich in der Oxidationsstufe +I vor, die Oxidationsstufen +II, +III och IV sind selten und meist nur in Komplexen stabil.
Silberhalogenid
Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im Licht und werden deshalb viel in der Fotografie gebraucht. Silberhalogenide är außer dem Fluorid schwer in Wasser löslich och dienen till Nachweis von Halogenid-Ionen.
- Silber(I)-fluorid AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht lichtempfindlich.
- Silber(I)-klorid AgCl ist ein weißes, kristallines wasserunlösiches Pulver. Es dient als Nachweis für Chloridionen. Außerdem wird es in Referenzelektroden und (seltener) in der Fotografie verwendet.
- Silber(I)-bromid ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Fotografie.
- Silber(I)-jodid ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Fotografie verwendet. Manchmal wird Silberiodid von Flugzeugen als Kondensationskeim zur Regenbildung versprüht.
- Silber(II)-fluorid AgF2 ist eines der wenigen nicht komplexen zweiwertigen Silbersalze. Es wird als Fluorierungsmittel an Stelle von elementarem Fluor verwendet.
Silberchalkogenide
- Silber(I)-oxid Ag2 O ist ein dunkelbrauner Feststoff, der aus silberhaltigen Lösungen mit Basen (z. B. Natronlauge) ausfällt. Bei höheren Temperaturen zerfällt Ag2 O in die Elemente.
Die Silberoxide mit Silber in Oxidationsstufen größer +I können nur auf elektrochemischen Wege dargestellt werden. Dies sind die Verbindungen Silber(I/III)-oxid AgAgO2 (fälschlicherweise auch Silber(II)-oxid AgO bezeichnet), Silber(II/III)-oxid Ag3 O4 und Silber(III)-oxid Ag2 O3 .
- Silber(I)-sulfid Ag2 S ist von allen Silbersalzen am schwersten wasserlöslich. Es ist schwarz und entsteht direkt aus den Elementen oder durch Versetzen silberhaltigen Lösungen mit Schwefelwasserstoff. Wenn Silberbesteck anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid.
weitere wichtige Silberverbindungen
- Silbernitrat AgNO3 ist die wichtigste Silberverbindung und Ausgangsstoff für die Herstellung der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in Salpetersäure hergestellt.
- Silbersulfat Ag2 SO4 entsteht beim Auflösen von Silber in konzentrierter Schwefelsäure.
- Silberazid AgN3 und Silberacetylid Ag2 C2 sind hochexplosiv. Ersteres kann als Initialzünder von Sprengstoffen dienen. Das ebenfalls sehr explosive Silberfulminat AgCNO wird auch als Knallsilber bezeichnet.
- Silbercyanid AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt.
Silber in höheren Oxidationsstufen tritt beispielsweise im Tetrapyridinosilber(II)-persulfat – [Ag(C5 H5 N)4 ]S2 O8 , im Kaliumtetrafluoroargentat(III) K[AgF4 ] oder Caesiumhexafluoroargentat(IV) Cs2 [AgF6 ] auf. Die giftigen Silbercyanide werden u. a. in galvanischen Bädern zur Versilberung und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von Komplexionen ausgeprägt, meist mit der Koordinationszahl 2. Diese Komplexionen sind mit Ausnahme des erst in starke salzsaurer Lösung entstehenden [AgCl2 ] nur in alkalischer (basischer) oder neutraler Lösung beständig.
Nachweis
Beim Zutropfen von Halogenid-Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z. B.:
- Cl(aq) + Ag(aq) → (aq) + AgCl(s)
Als Nachweisreaktion für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung:Ein weißer Niederschlag von Silberchlorid (komplex löslich in verdünntem Ammoniakwasser, es entsteht der Silberdiamminkomplex [Ag(NH3 )2 ] ). Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich Dichloroargentate(I) bilden:
- AgCl + Cl → [AgCl2 ]
Der Niederschlag ist bei Iodid-Ionen (AgI) gelb-grünlich und in Ammoniakwasser unlöslich, bei Chlorid- und Bromid-Ionen (AgCl, AgBr) weißlich.
Silber in der Medizin
Silber ist in feinstverteilter Form bakterizid, also schwach toxisch, was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an Schwefel gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches Silbersulfid aus.
Aus diesem Grund finden sie als Desinfektionsmittel und als Therapeutikum in der Wundtherapie Verwendung. Silberionen können silberempfindliche Erreger nach relativ langer Einwirkzeit reversibel inhibieren, können darüberhinaus bakteriostatisch oder sogar bakterizid (also abtötend) wirken. Man spricht hier vom oligodynamischen Effekt. In manchen Fällen werden Chlorverbindungen zugesetzt, um die geringe Wirksamkeit des Silbers zu erhöhen.
Dabei kommen verschiedene Wirkmechanismen zum Einsatz:
- Blockierung von Enzymen und Unterbindung deren lebensnotwendiger Transportfunktionen in der Zelle,
- Beeinträchtigung der Zellstrukturfestigkeit,
- Schädigung der Membranstruktur.
Die beschriebenen Effekte können zum Zelltod führen.
Neben der Argyrie, einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Körper außerdem zu Geschmacksstörungen, Geruchsunempfindlichkeit sowie zerebralen Krampfanfällen kommen.
Umstritten ist die therapeutische Einnahme von kolloidalem Silber, das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universalantibiotikum angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei peroraler Verabreichung stark anzuzweifeln. Zumindest kann die Silbersuspension selbst wenigstens in dieser Menge nicht zu einer Vergiftung des Patienten führen.
Heraldik
In der Heraldik wird Silber als Metall bezeichnet, das zu den heraldischen Tinkturen zählt. (siehe:Tingierung).
- Silberpflege
- Güldischsilber
- Silber/Tabellen und Grafiken
- Biologie:Silber-Ahorn, Silber-Salbei, Silberlinde, Silberner Grünrüssler
- Literatur:Der silberne Sessel
Quellen
- ↑ Handelsblatt Die Welt in Zahlen (2005)
Literatur
- Holleman-Wiberg:Lehrbuch der Anorganischen Chemie . Verlag de Gruyter, Berlin, 101. Auflage (1995), ISBN 3-11-012641-9
- Mineralienatlas – Silber
- Anwendung in der Medizintechnik
- Silver Institute – Verband von Silberproduzenten
- Grafiken zum Silberpreis
- Silberisotope
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase |
