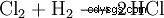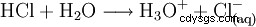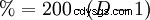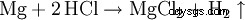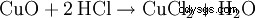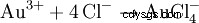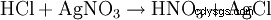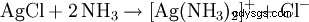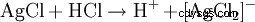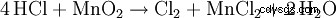| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Brak dostępnej formuły strukturalnej | |||||||
| Ogólne | |||||||
| Nazwa | Kwas solny | ||||||
| Inne nazwy |
| ||||||
| Formuła molekularna | Nie dotyczy | ||||||
| Numer CAS | 7647-01-0 | ||||||
| Krótki opis | bezbarwna do żółtawej ciecz o ostrym zapachu | ||||||
| Właściwości | |||||||
| Masa molowa | Nie dotyczy | ||||||
| Stan materii | ciecz | ||||||
| Gęstość | 1,19 g cm (37% roztwór) | ||||||
| Temperatura topnienia | -35°C (36% roztwór) | ||||||
| Temperatura wrzenia | 57 °C (36% roztwór) | ||||||
| Ciśnienie pary | 127 hPa (20 °C, 36% roztwór) | ||||||
| Rozpuszczalność | Chlorowodór można rozpuszczać w wodzie do stężenia 37% | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | 2 ml m lub 3,0 mg m | ||||||
| WGK | 1 - lekko niebezpieczne dla wody | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Kwas solny (nazwa systematyczna kwas solny ) jest wodnym roztworem gazowego chlorowodoru (wzór chemiczny HCl). Jest silnym kwasem nieorganicznym i należy do kwasów mineralnych. Sole kwasu solnego nazywane są chlorkami. Najbardziej znanym chlorkiem jest chlorek sodu (NaCl, sól kuchenna).
Historia
Kwas solny musiał być znany pierwszym alchemikom. Ich odkrycie przypisuje się Marii Prophetissa w I wieku i Geberowi w IX wieku.
Już w pierwszej połowie XV wieku Basilius Valentinus otrzymywał kwas solny w reakcji halitu (sól kamienna) z witriolem żelaza. Johannowi Rudolphowi Glauberowi udało się wyprodukować go z soli kuchennej i kwasu siarkowego w XVII wieku. Lavoisier nazwał kwas solny acid muriatique (łac. muria =solanka). Źródła solankowe są nadal nazywane źródłami muratycznymi wyznaczony. W Ameryce Północnej kwas solny jest również nazywany kwasem muratycznym dzwoniono.
Zdarzenia
W naturze kwas solny znajduje się w gazach wulkanicznych oraz w rozcieńczonych roztworach w jeziorach kraterowych. Występuje w postaci wolnej w soku żołądkowym kręgowców (0,1 do 0,5 proc. masy). Złoża soli kwasu solnego są prawie niewyczerpane, podobnie jak sól kamienna i rozpuszczona w wodzie morskiej.
Uzyskiwanie i wyświetlanie
Kwas solny produkowany jest w laboratorium ze stężonego kwasu siarkowego i soli kuchennej (stąd nazwa):
Kwas siarkowy wypiera chlorowodór z jego soli, chociaż chlorowodór jest silniejszym kwasem. Jest to możliwe, ponieważ chlorowodór jest gazem i praktycznie nierozpuszczalny w kwasie siarkowym. W rezultacie chlorowodór stale zanika z równowagi. Powstały siarczan to wodorosiarczan sodu, kwaśna sól.
W przemyśle chemicznym chlorowodór o wysokiej czystości otrzymuje się przez spalanie gazu detonującego chlor (mieszanina wodoru i chloru).
Aby uzupełnić kwas, rozpuść gazowy chlorowodór w wodzie:
Technicznie czysty kwas solny jest głównie produktem ubocznym chlorowania związków organicznych.
Właściwości
| % HCl | g HCl/l | Molarność | Gęstość |
|---|---|---|---|
| 10,5 | 110 | 3,06 | 1050 |
| 15,5 | 166 | 4.61 | 1075 |
| 20.4 | 224 | 6,22 | 1100 |
| 22,3 | 248 | 6,89 | 1110 |
| 24,3 | 272 | 7,56 | 1120 |
| 26,2 | 296 | 8,22 | 1130 |
| 28,2 | 321 | 8,92 | 1140 |
| 30,1 | 347 | 9,64 | 1150 |
| 32,1 | 372 | 10,23 | 1160 |
| 34,2 | 400 | 11,11 | 1170 |
| 36,2 | 428 | 11,89 | 1180 |
| 38,3 | 456 | 12,67 | 1190 |
| 40,4 | 485 | 13,47 | 1200 |
W temperaturze 0 °C gazowy HCl bardzo dobrze rozpuszcza się w wodzie (jeśli woda jest jeszcze w fazie ciekłej) (815 g lub 507 l na litr). To tworzy ciepło. W temperaturze 25°C jeden litr nasyconego kwasu solnego zawiera 825 g HCl (42,7%). Gęstość roztworu wynosi 1,20 g cm. Zależność gęstości od stężenia jest pokazana w sąsiedniej tabeli. Istnieje losowy matematyczny związek między gęstością a procentową zawartością HCl:podwojone miejsca po przecinku odpowiadają stężeniu, np. B. 1,10 g cm to gęstość 20% kwasu solnego.
Kwas chlorowodorowy o zawartości HCl ponad 36 procent wagowych jest również nazywany dymiącym kwasem chlorowodorowym oznaczone, ponieważ nad otwartymi naczyniami tworzy się biała mgła.
Czysty kwas solny można odparować bez pozostawiania pozostałości. Jeśli kwas chlorowodorowy o zawartości HCl powyżej 20% wag. zostanie podgrzany, więcej HCl niż woda ulatnia się, aż pozostanie mieszanina 20% HCl i 80% wody, co jest znane jako azeotrop. Dokładna zawartość HCl w azeotropie przy 1013 mbar wynosi 20,17%, temperatura wrzenia to 110 °C.
HCl dysocjuje całkowicie w wodzie, stężony kwas solny (32%) ma wartość pH -1. W wilgotnym powietrzu gazowy HCl tworzy mgłę drobnych kropelek kwasu chlorowodorowego.
Rozcieńczony kwas solny jest dobrym przewodnikiem elektryczności.
Reakcje
Kwas solny rozpuszcza większość metali z wyjątkiem metali szlachetnych takich jak m.in. tantal (german), miedź i rtęć (tylko w obecności tlenu) i srebro, tworząc chlorki i wodór, chyba że są chronione przez pasywację.
Bardzo dobrze nadaje się do szybkiego usuwania rdzy ze stali, ponieważ tlenki metali reagują z kwasem solnym tworząc chlorki i wodę:
Mieszanina kwasu solnego i kwasu azotowego nazywana jest wodą królewską, ponieważ może również rozpuszczać złoto, „król metali”. Oprócz utleniającego działania chlorku nitrozylu i powstającego chloru, zmniejszenie efektywnego stężenia jonów złota poprzez tworzenie kompleksu również przyczynia się do:
Wykorzystanie
Kwas solny ma duże znaczenie w przemyśle chemicznym jako kwas nieorganiczny. Kwas solny wykorzystywany jest m.in. w przeróbce rud i fosforytu. Jest stosowany w kwasowej obróbce odwiertów naftowych i gazowych oraz w obróbce metali do wytrawiania, trawienia i lutowania.
Kwas solny jest ważnym odczynnikiem w analizie chemicznej. Jest w stanie oddzielić grupę metali od innych metali przez wytrącanie. Można je następnie dalej analizować oddzielnie (patrz; grupa kwasu chlorowodorowego). Alkalimetria to kolejny obszar zastosowania kwasu solnego.
Jako dodatek do żywności kwas solny nosi oznaczenie E 507.
Znaczenie biologiczne
U ludzi i zwierząt kwas solny jest składnikiem soku żołądkowego, gdzie powoduje między innymi hydrolizę tłuszczów, ale także służy do zabijania zarazków, zanim dostaną się do dalszego układu pokarmowego.
Instrukcje bezpieczeństwa
Kontakt ze skórą powoduje oparzenia chemiczne. Pary są drażniące Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza. W razie wypadku lub złego samopoczucia natychmiast zasięgnij porady lekarskiej.
Dowód
Kwas solny jest wykrywany z jednej strony przez jego kwasowy charakter. Ponadto anion chlorkowy jest identyfikowany w silnie rozcieńczonym roztworze przez wytrącanie azotanem srebra w postaci chlorku srebra:
Powstały biały osad rozpuszcza się w wodzie amoniakalnej lub w stężonym kwasie solnym, tworząc kompleks:
Jeśli kwas solny jest podgrzewany w obecności dwutlenku manganu, powstaje gazowy chlor:
Procentową zawartość kwasu solnego określa się przez miareczkowanie sodą kaustyczną (→ kwasymetria, analiza objętościowa). To oznaczanie, jak również chlorków, można przeprowadzić fotometrycznie przy użyciu soli rtęciowej kwasu chloranilowego. Zawartość kwasu solnego w soku żołądkowym określa się za pomocą odczynnika Günzburga.
Referencje
- ↑ Wpis dotyczący kwasu solnego w bazie danych substancji GESTIS BGIA, pobranej 16 grudnia 2007 r. (wymagany JavaScript)
- ↑ Nils Wiberg, Egon Wiberg, Arnold O. Holleman:Podręcznik chemii nieorganicznej , wydanie 101, s. 460f., Gruyter 1995, ISBN 978-3-11-012641-9