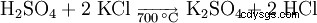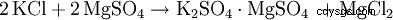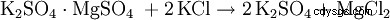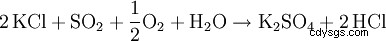| formula strutturale | |
|---|---|
| Generale | |
| nome | Solfato di potassio |
| Altri nomi |
|
| Formula molecolare | K2 SO4 |
| Numero CAS | 7778-80-5 |
| Breve descrizione | cristalli o polvere incolori |
| Proprietà | |
| Massa molare | 174,26 g/mol |
| Stato della materia | risolto |
| Densità | 2662 kg/m³ |
| Punto di fusione | 1069 °C |
| Punto di ebollizione | 1689 °C |
| Pressione di vapore | - |
| Solubilità | 111,1 g/l (acqua a 20 °C) 250 g/l (acqua a 100 °C), insolubile in etanolo |
| Istruzioni di sicurezza | |
| Simboli di pericolo | |
| - | |
| Frasi R e S |
R:nessuna frase di rischio |
| MAC | - |
| Le unità SI sono usate ove possibile e comuni. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |
Solfato di potassio , formula molecolare K2 SO4 , è il sale di potassio dell'acido solforico. Viene utilizzato principalmente come fertilizzante.
Cronologia
Il farmacista e chimico Johann Rudolph Glauber fu il primo a produrre il sale dal cloruro di potassio e dall'acido solforico, noto fin dal XIV secolo.
Occorrenze
Il solfato di potassio si trova in vari minerali sotto forma di cosiddetti sali doppi. Esempi di questo sono schoenite, leonite, langbeinite, polialite e glaserite.
Aspetto
Inizialmente, il solfato di potassio era derivato dalla kainite minerale (MgSO4 · KCl · 3 H2 O) ha vinto. Tuttavia, questo metodo di produzione fu presto abbandonato a favore di processi più economici a base di cloruro di potassio.
Una possibilità nella produzione di solfato di potassio è la reazione del cloruro di potassio con acido solforico a una temperatura di 700 °C.
In alternativa, il solfato di potassio è una doppia reazione con altri solfati metallici come. B. Solfato di magnesio:
Il cosiddetto processo di Hargreaves utilizza la reazione del cloruro di potassio con una miscela di anidride solforosa, aria e acqua per produrre solfato di potassio:
Il solfato di potassio è anche un sottoprodotto della produzione di acido nitrico.
Il solfato di potassio è più facile da produrre facendo reagire idrossido di potassio e acido solforico.
Proprietà
I cristalli anidri sono di natura rombica. Sono incolori e trasparenti, molto duri ed estremamente stabili all'aria. Il sapore del solfato di potassio è da amaro a salato. Sebbene solubile in acqua, è insolubile in etanolo.
Utilizzo
Il solfato di potassio viene utilizzato nella produzione di allume di potassio, bicchiere d'acqua di potassio, persolfato di potassio, potassio, flemmatori, acqua minerale, gomma sintetica e fertilizzanti misti. Viene anche utilizzato nella purificazione dell'acido tartarico e tartarico e in una varietà di usi nell'industria dei coloranti, degli esplosivi e farmaceutica.
Il solfato di potassio è usato come sostituto del sale da cucina negli alimenti dietetici. È anche un componente dei fertilizzanti di potassio utilizzati per fertilizzare colture vegetali sensibili al cloruro, ad es. B. essere utilizzato in viticoltura.
Ha il numero E 515 come additivo alimentare nell'UE approvato.
Il solfato di potassio è utilizzato anche come ingrediente attivo nelle polveri estinguenti di classe B e C.
Fonti
- ↑ BGIA Gestis Database delle sostanze pericolose
Holleman, Wiberg, Libro di testo di chimica inorganica , deGruyter Verlag, 101a edizione, p.1179