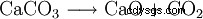| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | Oxyde de calcium | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | CaO | ||||||
| Numéro CAS | 1305-78-8 | ||||||
| Brève description | poudre blanche | ||||||
| Propriétés | |||||||
| Masse molaire | 56,08 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 3,37 g·cm (20 °C)> | ||||||
| Point de fusion | 2570-2580 °C | ||||||
| Point d'ébullition | 2850 °C (100 mbar) | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Oxyde de calcium (aussi chaux vive , chaux vive , chaux vive ou citron vert ) est une poudre blanche qui réagit avec l'eau en dégageant de la chaleur. La réaction produit de l'hydroxyde de calcium (chaux éteinte ) formé :
La chaux vive est softburned et durci distingué.
Fabrication
- Article principal : Cycle de chaux technique
À l'échelle industrielle, l'oxyde de calcium est produit par la combustion de la chaux. A partir d'une température d'environ 800 °C, le calcaire (carbonate de calcium) est désacidifié, c'est-à-dire que le dioxyde de carbone est expulsé et que de l'oxyde de calcium se forme.
On distingue entre autres la chaux vive selon la vitesse à laquelle la chaux réagit avec l'eau (processus dit d'extinction) :
<2 min temps de réaction :chaux douce
2 à 6 min de temps de réaction :chaux vive
> 6 min temps de réaction :chaux vive
Cependant, aucune définition précise n'existe.
Les différences de vitesse de réaction sont une conséquence de la taille des cristallites du CaO, du volume des pores et de la surface spécifique, qui sont influencés par la température et la durée de cuisson.
Chaux vive douce produit à des températures de 900-1000 °C, chaux vive jusqu'à 1400 °C, la durée de l'effet de température jouant généralement également un rôle.
Lorsque de plus petites quantités (échelle du laboratoire) sont suffisantes, il peut être obtenu en oxydant le calcium.
L'oxyde de calcium réactif est obtenu en décomposant thermiquement l'hydroxyde de calcium, qui se décompose à 550 ° C sous pression atmosphérique en oxyde de calcium et en eau. L'oxyde de calcium formé dans ces conditions n'est pas très cristallin, il est donc très réactif.
La chaux vive (quickfast) et la chaux éteinte (hydroxyde de calcium) sont très corrosives (pH 12-13), le contact avec les yeux peut rendre aveugle !
Utilisation
La chaux vive est utilisée dans l'industrie de la construction comme adjuvant au mortier, et c'est aussi un composant mineur du clinker de ciment. En chimie, la substance est également utilisée comme agent de séchage. D'autres domaines d'application de la chaux vive sont par ex. B. chaux fertilisante, pour la production de carbure de calcium et pour la production de mortier à la chaux, d'enduit à la chaux et de peinture à la chaux et pour une utilisation comme agent neutralisant.
L'un des principaux domaines d'application est la désulfuration de la fonte brute, où le soufre [S] apparaît comme un compagnon [FeS] et doit être dissous sur le chemin de l'acier (convertisseur). dans la fonte ou avec un agitateur mélangé. La chaux se combine avec le soufre pour former du sulfure de calcium [CaS] et remonte à la surface où elle se dépose sous forme de laitier. Celui-ci est éliminé avec une machine à gratter après désulfuration.
L'oxyde de calcium est une application importante en tant que précurseur dans la production d'hydroxyde de calcium en ajoutant de l'eau (chaux éteinte ou chaux éteinte ).
La chaux éteinte est utilisée, entre autres, comme alternative au calcaire dans la désulfuration des fumées. La quantité utilisée ici est environ 1,8 fois inférieure à celle du calcaire. Le gypse (sulfate de calcium) obtenu à partir de chaux vive a un degré de blancheur de 80% et peut être utilisé commercialement. En raison de sa grande réactivité, des quantités de consommation plus faibles sont nécessaires. L'inconvénient est son prix nettement plus élevé par rapport au calcaire.
La chaux chlorée peut être produite à partir d'hydroxyde de calcium par d'autres réactions.
Il est ajouté aux aliments comme régulateur d'acidité. Il est principalement utilisé comme adjuvant dit technique qui n'est plus présent dans les aliments finis. Dans l'UE, il est classé comme additif alimentaire avec la désignation E 529 sans limite maximale (quantum satis ) généralement approuvé pour l'alimentation.
Origine
- ↑ Entrée sur oxyde de calcium dans la base de données des substances GESTIS du BGIA, récupérée le 4 octobre 2007 (JavaScript requis)
- ↑ Fiche de données de sécurité (Merck)