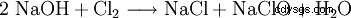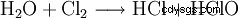| fórmula estructural | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| General | ||||||||
| Nombre | Hipoclorito de sodio | |||||||
| Otros nombres | hipoclorito de sodio, hipoclorito de sodio, hipoclorito de sodio, L'eau de Labarraque/Eau de Javel (solución acuosa) | |||||||
| Fórmula molecular | NaOCl | |||||||
| Número CAS | 7681-52-9 | |||||||
| Breve descripción | sólido amarillo con olor desagradable y dulce | |||||||
| Propiedades | ||||||||
| Masa molar | 74,44 g mol | |||||||
| Estado de la materia | arreglado | |||||||
| Densidad | 1,2 g cm (solución de cloro libre al 13 %) | |||||||
| Punto de fusión | 24,5 °C (pentahidratado) | |||||||
| Presión de vapor | 23 hPa (20 °C) | |||||||
| Solubilidad | bueno en agua (293 g/L a 0 °C, 942 g/L a 23 °C, cada pentahidrato) | |||||||
| Instrucciones de seguridad | ||||||||
| ||||||||
| WGK | 2 – peligroso para el agua | |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | ||||||||
Hipoclorito de sodio (NaOCl) es la sal sódica del ácido hipocloroso (también conocido como hipocloroso) (HClO).Es un polvo blanco que normalmente contiene seis moles de agua de cristalización por mol de hipoclorito de sodio. El nombre común de la solución acuosa de hipoclorito de sodio es Eau de Labarraque o Eau de Javel , donde la etiqueta Eau de Javel es estrictamente incorrecto. Esto se refiere a una solución de hipoclorito de potasio, posiblemente en una mezcla con otras sales como el cloruro de potasio; sin embargo, a menudo no se distingue.
Obtención/Representación
El hipoclorito de sodio se produce introduciendo cloro gaseoso en la sosa cáustica o electrolizando una solución de cloruro de sodio.
Esta reacción provoca importantes problemas técnicos. Ya que es formalmente una hidrólisis del cloro según
con la subsiguiente neutralización del ácido clorhídrico o ácido hipocloroso resultante, es fácil ver que las entalpías de reacción de estas reacciones conducen a un fuerte calentamiento, al que son sensibles todos los hipocloritos. De hecho, se usa el mismo proceso químico para hacer clorato, pero haciéndolo reaccionar en una solución caliente. Por esta razón, todos los hipocloritos técnicos contienen cantidades variables, a veces grandes, de clorato. La reacción del hipoclorito producido durante la producción con el cloro finalmente conduce al clorato.
Uso
El propósito de uso es blanquear o desinfectar (por ejemplo, en piscinas). El uso en piscinas no deja de ser problemático, ya que las cantidades a dosificar deben ser suficientes para clorar el amoníaco presente (o las aminas) por encima del nivel de monocloramina, ya que sólo así se garantiza una desinfección adecuada.
El hipoclorito de sodio también es el principal ingrediente activo en los limpiadores domésticos desinfectantes y blanqueadores como DanKlorix y muchos otros. Varios eliminadores de moho también contienen este ingrediente activo.
El hipoclorito de sodio también se usa en odontología. Por ejemplo, se utiliza en el tratamiento de conductos de dientes infectados por bacterias para desinfectarlos.
Instrucciones de seguridad
¡Se requiere extrema precaución al manipular hipoclorito de sodio! Existe riesgo de explosión cuando el hipoclorito de sodio reacciona con numerosas sustancias y grupos de sustancias, incluidos agentes reductores, aminas, ácido fórmico, metanol, sustancias orgánicas y algunas otras. Ataca fuertemente las mucosas cuando se inhala.
Además, el hipoclorito de sodio reacciona con ácidos (p. ej., ácido clorhídrico, ácido nítrico) y agentes oxidantes (p. ej., peróxido de hidrógeno, permanganato), a veces de forma muy violenta, generando calor y liberando cloro gaseoso y/o gases nitrosos.
El calor o la luz solar por sí solos pueden hacer que el hipoclorito de sodio se descomponga, liberando cloro, cloruro de hidrógeno, dióxido de cloro y oxígeno, entre otras cosas. Esto también debe tenerse en cuenta al almacenar la sustancia.
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 12 de mayo 2007