| Bórax | |
| Cristales de bórax de California | |
| Química | Na2 [B4 O5 (OH)4 ] · 8H2 O |
| Clase de minerales | Grupo boratos V/H.10-30 (según Strunz) 26.4.1.1 (según Dana) |
| Sistema de Cristal | monoclínico |
| Clase de cristal | monoclínico-prismático 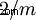 |
| Color | incoloro, blanco, gris, amarillo, verde |
| Color del trazo | blanco |
| Dureza de Mohs | 2 a 2,5 |
| Densidad (g/cc) | 1,72 |
| Brillo | Vítreo a mate |
| Transparencia | transparente a opaco |
| Fracción | concha |
| Escisión | perfecto |
| Habitus | cristales tabulares o prismáticos cortos, columnares, terrosos, granulares, agregados masivos |
| Caras de cristal comunes | |
| Hermandad | |
| Aspecto cristalino | |
| Índice de refracción | α=1,447 β=1,469 a 1,470 γ=1,472 |
| Birrefringencia (orientación óptica) | Δ=0,025; 39° a 40°, biaxial negativo |
| pleocroísmo | incoloro |
| Ángulo/dispersión de los ejes ópticos | 2vz ~ |
| Propiedades adicionales | |
| Transiciones de fase | |
| Punto de fusión | 878 °C |
| Comportamiento químico | soluble en agua y glicerina |
| Minerales similares | kernita, colemanita, sassoline, sosa, trona |
| Radiactividad | no radiactivo |
| Magnetismo | no magnético |
| Marcas distintivas | |
Bórax , también conocido como Tinkal , borato de sodio o por su nombre químico Tetraborato disódico decahidratado conocido, es un mineral de borato bastante raro de la clase de minerales del grupo de los boratos. Cristaliza en el sistema cristalino monoclínico con la fórmula química Na2 [B4 O5 (OH)4 ] · 8H2 O o Na2 B4 O7 · 10H2 O o Na2 O x 2 B2 O3 · 10H2 O y desarrolla principalmente cristales prismáticos o tabulares cortos, pero también agregados terrosos, granulares o masivos, en su mayoría de color blanco o gris. Ocasionalmente es incoloro.
Propiedades especiales
Cuando se calienta a unos 100 °C, pierde parte de su agua de cristalización y forma un pentahidrato. Por encima de 400 °C se obtiene tetraborato de sodio anhidro, que funde a 878 °C. La masa molar del tetraborato de sodio es 201,22 g mol, la del decahidrato es 381,37 g mol. La densidad de la sustancia anhidra es de 2,37 g cm, la del decahidrato es de 1,72 g cm.
Etimología e Historia
El bórax fue descrito por primera vez en 1748 por el mineralogista sueco Johan Gottschalk Wallerius. El nombre deriva de la palabra árabe bauraq por "blanco". Ya se usaba en la antigüedad en China para veladuras y en Egipto para embalsamamiento.
Formación y localidades
El bórax se presenta en la naturaleza en forma cristalina o sólida similar a la anhidrita o al yeso como evaporita, es decir, se forma por el secado de lagos salados, que también se denominan lagos de bórax, y por lo tanto se presenta como sedimento. También se puede encontrar en respiraderos volcánicos.
Una ocurrencia natural se encuentra en Boron, California, donde se extrae a cielo abierto. Otras localidades incluyen Kırka en Turquía, así como Borax Lake y Searles Lake/California en EE. UU.
Hoy en día, el bórax se obtiene casi exclusivamente del mineral kernit de bórax, que tiene menos agua cristalina.
Uso
como materia prima
El bórax es una materia prima importante para la producción de ácido bórico, para la producción de boratos y perboratos, así como de otros compuestos de boro. El bórax se utiliza para vidriar loza, cerámica, porcelana, vidrio y en la producción de esmalte.
Su uso como fundente en la soldadura fuerte de metales preciosos, así como en la soldadura en fragua y en la forja se basa en su efecto desoxidante (antioxidante).
El bórax es un ingrediente básico para hacer el juguete Slime, junto con el alcohol polivinílico, el agua destilada y el colorante alimentario.
en química
Numerosos óxidos metálicos se disuelven en la masa fundida de bórax, formando colores característicos y, después de enfriarse, forman una perla similar al vidrio, la perla de bórax. Estas manchas se utilizan para identificar cationes en el proceso de separación de cationes.
El color verde de la llama que se produce cuando se quema metanol con bórax y es causado por el borato de trimetilo es un indicador simple de metanol.
Además, el bórax se utiliza para soluciones tampón (tampones de borato y borato-fosfato) y en la solución de bórax-carmín (solución Grenachers ) utilizado como colorante en microscopía.
en el hogar
En el hogar, el bórax se usa en jabones, ablandadores de agua y como perborato en detergentes. El bórax se usa en desinfectantes, agentes de limpieza y lejías, así como en insecticidas (para trampas para hormigas).
Además, el bórax actúa como un conservante preventivo de la madera contra el moho y los insectos y se utiliza en aproximadamente el uno por ciento de la cantidad total consumida como retardante de llama, aquí principalmente para materiales de aislamiento a base de celulosa. En la última aplicación, sus propiedades se consideran parcialmente problemáticas y se considera sensata una reducción.
Como aditivo alimentario, tiene la designación E 285.
Precauciones
[[Ayuda:Caché|Error al crear la miniatura]]:El bórax puede causar inflamación si entra en contacto con la piel o los ojos, o si se inhala el polvo fino. La ingestión puede causar irritación del tracto gastrointestinal; cantidades mayores son mortales (frases R y S:R:36/37-62, S:22-26-36/37/39-45).
El número CAS de tetraborato de sodio anhidro es 1330-43-4, pentahidratado 1332-28-1 y bórax (tetraborato de sodio decahidratado) 1303-96-4.
- Sistemática de minerales
- Lista de minerales
Pruebas individuales
- ↑ Webmineral - Bórax
- ↑ MinDat - Bórax
- ↑ Entrada sobre tetraborato de sodio en la base de datos de sustancias GESTIS de BGIA, recuperada el 25 de septiembre de 2007 (Se requiere JavaScript)
- ↑ Martin Okrush, Siegfried Matthes:Mineralogía . 7ª edición. Springer Verlag, Berlín 2005, ISBN 3-540-23812-3
- ↑ Enciclopedia básica compacta de química de Römpp . Editado por Jürgen Falbe y Manfred Regitz. Editado por Eckard Amelingmeier y otros Thieme, Stuttgart/Nueva York 1998, ISBN 3-13-115711-9
- ↑ Pigmentos Kremer - Bórax
- ↑ Universidad de Bayreuth – Experimentos de efectos:Slime
- ↑ Leisewitz et al. Informe de investigación nº 297 44 542 en nombre de la Agencia Federal de Medio Ambiente (diciembre de 2000), página 121 y sigs.
Referencias
- Edición Dörfler:Enciclopedia de minerales , Nebel Verlag, ISBN 3-89555-076-0
