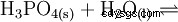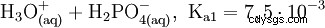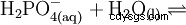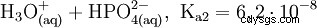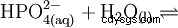| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | acido fosforico | ||||||
| Altri nomi | acido ortofosforico | ||||||
| Formula molecolare | H3 PO4 | ||||||
| Numero CAS | 7664-38-2 | ||||||
| Breve descrizione | solido incolore e inodore | ||||||
| Proprietà | |||||||
| Massa molare | 98,00 g mol | ||||||
| Stato della materia | solido (spesso liquido, poiché una massa fusa super raffreddata può essere conservata a lungo) | ||||||
| Densità | 1,834 g cm (18°C) | ||||||
| Punto di fusione | 42,35°C | ||||||
| Punto di ebollizione | Decomposizione:213 °C (disidratazione) | ||||||
| Pressione di vapore | 3,8 Pa (20 °C) | ||||||
| valore pKa | 2.16; 7.21; 12.32 | ||||||
| Solubilità | completamente miscibile con acqua, prontamente solubile in alcool | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | 2 mg m (frazione di aerosol respirabile) | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Il normale o orto- Acido fosforico è il principale acido del fosforo. La sostanza anidra è altamente igroscopica. È un acido triprotico e reagisce come acido moderatamente forte rispetto alla prima deprotonazione. Da esso derivano i condensati acido difosforico, acido meta- e polifosforico. Come additivo alimentare, l'acido fosforico è elencato come E 338 dichiarato.
Ottenere e visualizzare
L'acido fosforico può essere ottenuto dal fosfato naturale (principalmente apatite, Ca5 (PO4 )3 (F, OH, Cl)) con acido solforico, acido cloridrico o acido nitrico. I CaSO4 si formano come sottoprodotti (anidride, gesso) e H2 [SiF6 ] (acido esafluorosilicico). In alternativa, l'acido fosforico può essere ottenuto bruciando fosforo elementare per formare anidride fosforica, P4 O10 , e successiva idrolisi (il cosiddetto acido fosforico termico).
Proprietà
L'acido fosforico è un acido tribasico che può donare il suo idrogeno come protoni solvati in tre stadi per formare anioni diidrogeno fosfato, idrogeno fosfato e fosfato. I valori pKs associati sono pKs1 =2.161; pKs2 =7.207 e pKs3 =12.325.
Utilizzo
L'acido fosforico viene utilizzato come materia prima per la produzione di fertilizzanti contenenti fosfati (>90% della produzione negli USA), detergenti, antiruggine o convertitori di ruggine e per la passivazione del ferro e dello zinco per la protezione dalla corrosione. Il cemento al fosfato di zinco è utilizzato in odontoiatria.
Pur avendo un effetto caustico in alte concentrazioni, viene utilizzato diluito nell'industria alimentare come conservante, acidificante (soprattutto nelle bevande a base di cola) e come regolatore di acidità (E 338), poiché l'acido fosforico non è tossico per l'organismo umano , a parte il suo effetto caustico. È adatto anche per la preparazione di soluzioni tampone (vari “tamponi fosfato”).
Importanza biologica
Gli esteri dell'acido fosforico svolgono un ruolo centrale nel metabolismo, in particolare come vettori energetici e di gruppo (vedi ad esempio ATP e GTP). Sono parte integrante del DNA, dell'RNA, di molti coenzimi, ecc.
Prova
L'acido fosforico e i fosfati solubili possono essere separati mediante precipitazione con molibdato di ammonio per formare fosfato di molibdato di ammonio giallo, o mediante precipitazione con ioni magnesio in una soluzione ammoniacale per formare MgNH4 PO4 dimostrare.
Fonti
- ↑ RÖMPP Online, Thieme 2007
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 3 marzo 2007
- ↑ ESIS-Sistema europeo di informazione sulle sostanze chimiche
- altri composti ossigenati del fosforo