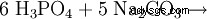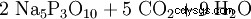| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | Triphosphate pentasodique | ||||||
| Autres noms | |||||||
| Formule moléculaire | Na5 P3 O10 | ||||||
| Numéro CAS | 7758-29-4 | ||||||
| Brève description | sel de sodium incolore d'un oligo-phosphate | ||||||
| Propriétés | |||||||
| Masse molaire | 367,86 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2,53 g cm | ||||||
| Point de fusion | 622 °C (décomposition) | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Triphosphate pentasodique ou tripolyphosphate de sodium est un sel de sodium incolore de l'anion triphosphate , appartient aux phosphates et a la formule empirique Na5 P3 O10 . Le nom triphosphate est parfois utilisé à la place du triphosphate pentanosodique utilisé. Les triphosphates font également partie de composés organiques tels que l'adénosine triphosphate. Il porte le numéro E 451 en tant qu'additif alimentaire dans l'UE approuvé.
Synthèse
Le triphosphate pentasodique est formé par condensation d'acide ortho-phosphorique :
Utilisation
Les triphosphates sont utilisés dans les détergents pour adoucir l'eau et ainsi soutenir l'efficacité des tensioactifs.Les anions triphosphate du triphosphate pentasodique, par exemple, forment des composés stables et solubles dans l'eau avec les ions calcium et magnésium. C'est donc un bon agent complexant qui empêche la formation de composés peu solubles, appelés "savons de chaux", à partir des métaux alcalino-terreux, qui se déposent ensuite, par exemple, sur les éléments chauffants des machines à laver ou sur le linge et ainsi altérer l'effet du détergent, des tensioactifs.
Les triphosphates sont également utilisés dans les stations d'épuration. Ici, ils sont divisés et des phosphates se forment.
En raison de la surfertilisation des eaux de surface, qui peut être causée par les phosphates, une grande partie des phosphates est aujourd'hui remplacée par la "zéolithe A", c'est-à-dire un silicate d'aluminium et de sodium.
Origine
- ↑ de.chemdat.info