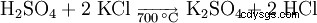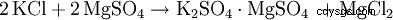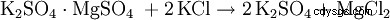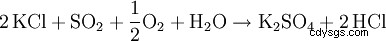| fórmula estructural | |
|---|---|
| General | |
| nombre | sulfato de potasio |
| Otros nombres |
|
| Fórmula molecular | K2 SO4 |
| Número CAS | 7778-80-5 |
| Breve descripción | cristales o polvo incoloro |
| Propiedades | |
| Masa molar | 174,26 g/mol |
| Estado de la materia | arreglado |
| Densidad | 2662 kg/m³ |
| Punto de fusión | 1069 °C |
| Punto de ebullición | 1689 °C |
| Presión de vapor | - |
| Solubilidad | 111,1 g/l (agua a 20 °C) 250 g/l (agua a 100 °C), insoluble en etanol |
| Instrucciones de seguridad | |
| Símbolos de peligro | |
| - | |
| Frases R y S |
R:sin frases de riesgo |
| MAC | - |
| Las unidades SI se utilizan siempre que sea posible y comunes. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |
Sulfato de potasio , fórmula molecular K2 SO4 , es la sal potásica del ácido sulfúrico. Se utiliza principalmente como fertilizante.
Historia
El farmacéutico y químico Johann Rudolph Glauber fue el primero en producir la sal de cloruro de potasio y ácido sulfúrico, que se conoce desde el siglo XIV.
Ocurrencias
El sulfato de potasio se encuentra en varios minerales en forma de las llamadas sales dobles. Ejemplos de esto son la schoenita, la leonita, la langbeinita, la polihalita y la glaserita.
Apariencia
Inicialmente, el sulfato de potasio se derivó del mineral kainita (MgSO4 · KCl · 3H2 O) ganó. Sin embargo, este método de producción pronto se abandonó en favor de procesos más rentables basados en cloruro de potasio.
Una posibilidad en la producción de sulfato de potasio es la reacción de cloruro de potasio con ácido sulfúrico a una temperatura de 700 °C.
Alternativamente, el sulfato de potasio es una reacción doble con otros sulfatos metálicos. B. Sulfato de magnesio:
El llamado proceso de Hargreaves utiliza la reacción del cloruro de potasio con una mezcla de dióxido de azufre, aire y agua para producir sulfato de potasio:
El sulfato de potasio también es un subproducto de la producción de ácido nítrico.
El sulfato de potasio es más fácil de producir al hacer reaccionar el hidróxido de potasio y el ácido sulfúrico.
Propiedades
Los cristales anhidros son de naturaleza rómbica. Son incoloros y transparentes, muy duros y extremadamente estables en el aire. El sabor del sulfato de potasio es amargo a salado. Si bien es soluble en agua, es insoluble en etanol.
Uso
El sulfato de potasio se utiliza en la producción de alumbre de potasio, vidrio soluble de potasio, persulfato de potasio, potasa, flemadores, agua mineral, caucho sintético y fertilizantes mixtos. También se utiliza en la purificación de ácido tartárico y tartárico y en una variedad de usos en las industrias de colorantes, explosivos y farmacéutica.
El sulfato de potasio se utiliza como sustituto de la sal de mesa en los alimentos dietéticos. También es un componente de los fertilizantes potásicos utilizados para fertilizar cultivos de plantas sensibles al cloruro, p. B. utilizarse en viticultura.
Tiene el número E 515 como aditivo alimentario en la UE aprobado.
El sulfato de potasio también se utiliza como ingrediente activo en los polvos extintores de clase B y C.
Fuentes
- ↑ Base de datos de sustancias peligrosas de BGIA Gestis
Holleman, Wiberg, Libro de texto de química inorgánica , deGruyter Verlag, edición 101, página 1179