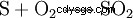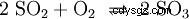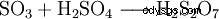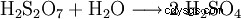| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | Kwas siarkowy | ||||||
| Inne nazwy | Kwas siarkowy(VI), olej witriolowy, dihydrosiarczan, kwas monotionowy | ||||||
| Formuła molekularna | H2 SO4 | ||||||
| Numer CAS | 7664-93-9 | ||||||
| Krótki opis | bezbarwna i bezwonna, lekko lepka ciecz | ||||||
| Właściwości | |||||||
| Masa molowa | 98,08 g mol | ||||||
| Stan materii | ciecz | ||||||
| Gęstość | 1,8356g cm | ||||||
| Temperatura topnienia | 10,38°C | ||||||
| Temperatura wrzenia | 279,6°C | ||||||
| Ciśnienie pary | 1,3 hPa (145,8 °C) | ||||||
| Rozpuszczalność | całkowicie mieszalny z wodą | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | 0,1 mg m (mierzone jako wdychana frakcja aerozolu) | ||||||
| LD50 | 2140 mg kg (szczur) | ||||||
| WGK | 1 - lekko niebezpieczne dla wody | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Kwas siarkowy (według IUPAC:Diwodorosiarczan ) jest bezbarwną, lepką cieczą i silnym kwasem nieorganicznym. Jest jednym z kwasów mineralnych i jedną z 20 najważniejszych substancji chemicznych w przemyśle chemicznym. Jako dodatek do żywności ma numer E 513 .Rozcieńczony kwas siarkowy nazywa się rozcieńczonym kwasem. Do XIX wieku kwas siarkowy nosił też trywialną nazwę olejek witriolowy (pochodzący od witrioli), który dziś nie jest już używany.
Sole i estry kwasu siarkowego nazywane są siarczanami i wodorosiarczanami. Siarczany podobne do soli zawierają jon siarczanowy (SO4 ).
Uzyskiwanie i wyświetlanie
W przeszłości kwas siarkowy był wytwarzany w procesie witriolowym i w komorze ołowianej. Nowoczesne metody to metoda kontaktu i rozwinięta na jej podstawie metoda podwójnego kontaktu.
Najstarszym procesem wytwarzania kwasu siarkowego jest proces witriolowy. Był używany przez alchemików w XIII wieku. Witriole to siarczany, które stosunkowo łatwo ulegają rozkładowi termicznemu, tworząc trójtlenek siarki i tlenek metalu. Johann Rudolph Glauber (1604–1670) zbudował pierwszą na świecie wytwórnię kwasu siarkowego, która wykorzystała ten proces do produkcji kwasu siarkowego około 1650 r. w Nordhausen (Harz).
W procesie kontaktowym produkcja odbywa się w trzech etapach, zaczynając od siarki elementarnej (S) i tlenu (O2 ) Dwutlenek siarki (SO2 ) jest wyświetlane:
Dwutlenek siarki jest dalej utleniany pięciotlenkiem wanadu (V2 O5 ) jako katalizator do trójtlenku siarki (SO3 ) wdrożono:
Trójtlenek siarki jest bezwodnikiem kwasu siarkowego. Ze względu na niską rozpuszczalność w wodzie nie jest wprowadzany bezpośrednio do wody, ale do stężonego kwasu siarkowego, przez co jest bardzo dobrze przyswajalny.
Powstający kwas disiarkowy jest stale rozcieńczany wodą.
Właściwości
Kwas siarkowy o wzorze cząsteczkowym H2 SO4 jest silnym kwasem (pKS1 =-3, pKS2 , co odpowiada pKS anionu wodorosiarczanowego HSO4 =1,9). Jako silny kwas nieorganiczny należy do kwasów mineralnych. Stężony kwas siarkowy jest również silnym środkiem utleniającym. Jest również higroskopijny i dlatego może być używany do suszenia gazów i cieczy. Zniekształcona tetraedryczna cząsteczka kwasu siarkowego ma duży moment dipolowy, którego biegun dodatni znajduje się między dwiema grupami OH.
Kwas siarkowy tworzy z wodą azeotrop. Jeśli 100% kwas siarkowy zostanie podgrzany do wrzenia, trójtlenek siarki odparowuje aż do osiągnięcia stężenia około 98% wagowych. Odwrotnie, rozcieńczony kwas siarkowy można doprowadzić do tego stężenia przez gotowanie.
100% kwas siarkowy wytwarza się przez barbotowanie trójtlenku siarki do około 98% wagowo kwasu siarkowego, aż do uzyskania bezwodności. Kwas siarkowy może również wiązać duże ilości trójtlenku siarki, powstałą ciecz nazywa się oleum ze względu na wysoką lepkość. Oleum składa się z mieszaniny kwasu siarkowego i wielosiarkowego (kwas dwusiarkowy:H2 S2 O7 , kwas trójsiarkowy H2 S3 O10 itp.) Oleum zawierające do 65% wagowych tritlenku siarki jest dostępne w handlu. Oleum stosuje się w reakcjach chemicznych do sulfonowania lub gdy konieczne jest związanie jak największej ilości wody z reakcji. Minimalizuje to zużycie kwasu siarkowego i często maksymalizuje wydajność.
Aby określić stężenie, mierzy się gęstość kwasu siarkowego. Stężenie można zatem bezpośrednio wyprowadzić ze standardowych tabel. Na przykład określany jest stan naładowania akumulatora samochodowego (patrz również akumulator kwasowo-ołowiowy).
Podczas rozcieńczania stężonego kwasu siarkowego uwalnia się dużo ciepła. Dlatego należy podjąć odpowiednie środki ostrożności. Ważne jest, aby zawsze kwas woda jest wmieszany, tj. nie woda kwasu ! W przeciwnym razie woda może gwałtownie odparować, powodując niekontrolowane wytryskiwanie cieczy; niebezpieczeństwo jest oczywiste. Mnemonik:"Najpierw woda, potem kwas, w przeciwnym razie zdarzy się potworność."
Znaczenie i zastosowanie
Kwas siarkowy jest jedną z najczęściej produkowanych chemikaliów. W 1997 roku na całym świecie wyprodukowano ponad 130 milionów ton. Możliwe zastosowania są bardzo różnorodne. Stosowany jest kwas siarkowy
- do mineralizacji rud (np. w tlenku tytanu(IV) lub mineralizacji uranu)
- do produkcji siarczanów
- do produkcji innych kwasów (np. kwasu fluorowodorowego lub fosforowego)
- do produkcji nawozów za pomocą kwasu azotowego
- do produkcji surfaktantów
- jako katalizator
- do obróbki metali
- jako środek osuszający
- jako środek pomocniczy w reakcji (kwas azotowy)
- w akumulatorach samochodowych
- do trawienia półprzewodników
- ze względu na przewodność elektryczną jako dodatek do wody w elektrolizie
- jako rozpuszczalnik podczas palenia
- w analityce w celu określenia liczb lepkości poliamidu
- do produkcji dwutlenku tytanu
W przemyśle spożywczym kwas siarkowy jest stosowany jako dodatek techniczny do produkcji skrobi modyfikowanej i kazeiny oraz do uzdatniania wody pitnej. Nie wpływa do produktu końcowego i dlatego nie występuje lub występuje tylko w ilościach nieszkodliwych dla zdrowia. W Unii Europejskiej kwas siarkowy nie musi być deklarowany na opakowaniu produktu.
Rozpuszczenie nadmanganianu potasu w kwasie siarkowym do nasycenia daje ciemnozieloną oleistą ciecz (heptoksyd dimanganu), który jest silnym środkiem utleniającym. Natychmiast zwęgla materiały organiczne, takie jak drewno i samorzutnie spala się z acetonem lub innymi paliwami. Rozpuszczając dwuchromian potasu w kwasie siarkowym, otrzymuje się chromowy kwas siarkowy, substancję powszechnie stosowaną w przeszłości do czyszczenia w laboratoriach.
Ilość produkowanego kwasu siarkowego była wskaźnikiem efektywności krajowego przemysłu chemicznego. Duże ilości kwasu siarkowego są zużywane w II fazie rozwoju przemysłu chemicznego.
Fazy rozwoju:
- I. Dominujące spożycie sody kaustycznej
- II. Przeważające zużycie kwasu siarkowego III. przeważające zużycie chloru
Struktura i wiązanie
W cząsteczce kwasu siarkowego, podobnie jak w anionie wodorosiarczanowym, atom siarki ma zaburzoną koordynację czworościenną. Dwa wiązania S-O z grupami OH są zauważalnie dłuższe niż z dwoma „gołymi” atomami tlenu. Znalezione długości wiązań odpowiadają rzędom wiązań 1 i 2. W często używanej notacji z (kowalencyjnymi) podwójnymi wiązaniami i bez formalnych ładunków, wiązanie czterech atomów tlenu z siarką nie może być wyjaśnione bez użycia orbitali 3d stosować siarkę dla wiązań π (por. PSE). Jednak szczegółowe rozważania teoretyczne pokazują, że orbitale d w niewielkim stopniu przyczyniają się do wiązania w związkach pierwiastków grupy głównej. Krótsze wiązanie z „gołymi” atomami tlenu jest zatem lepiej opisane jako pojedyncze wiązanie kowalencyjne, które jest skracane przez dodatkowe oddziaływania elektrostatyczne. Oddzielenie ładunku można wyprowadzić z pojedynczej mezomerycznej struktury granicznej, która jest zgodna z regułą oktetu.
Dowód
Kwas siarkowy można wykryć w postaci anionu siarczanowego. Na przykład wytrącanie w postaci słabo rozpuszczalnego mikrokrystalicznego siarczanu baru po dodaniu roztworu chlorku baru służy do wykrywania siarczanu.
Ważne połączenia
Sole:
- Siarczan miedzi (Witriol miedzi)
- Siarczan wapnia (gips, alabaster, anhydryt) (CaSO4 )
- Siarczan baru (baryt, ciężki dźwigar) (BaSO4 )
- Alum (mieszane siarczany glinu z innymi kationami)
- Aluminit
- Siarczan żelaza (Witriol żelaza)
- Siarczan sodu (sól glaubera)
Estry:
- siarczan dimetylu (rozpuszczalnik, środek metylujący; bardzo toksyczny)
Źródła
- ↑ Wpis dotyczący kwasu siarkowego w bazie danych substancji GESTIS BGIA, pobranej 31 marca 2007 r. (wymagany JavaScript)
- Kwas siarkawy H2 SO3 (diwodorosiarczyn)
- Punkt rosy kwasu siarkowego