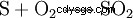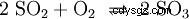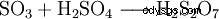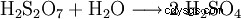| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | Ácido sulfúrico | ||||||
| Otros nombres | Ácido sulfúrico (VI), aceite de vitriolo, dihidrosulfato, ácido monotiónico | ||||||
| Fórmula molecular | H2 SO4 | ||||||
| Número CAS | 7664-93-9 | ||||||
| Breve descripción | líquido incoloro e inodoro, ligeramente viscoso | ||||||
| Propiedades | |||||||
| Masa molar | 98,08 g mol | ||||||
| Estado de la materia | líquido | ||||||
| Densidad | 1,8356 g·cm | ||||||
| Punto de fusión | 10,38 °C | ||||||
| Punto de ebullición | 279,6 °C | ||||||
| Presión de vapor | 1,3 hPa (145,8 °C) | ||||||
| Solubilidad | completamente miscible con agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | 0,1 mg m (medido como fracción de aerosol inhalable) | ||||||
| LD50 | 2140 mg kg (rata) | ||||||
| WGK | 1 - ligeramente peligroso para el agua | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Ácido sulfúrico (según IUPAC:Dihidrogensulfato ) es un líquido incoloro, viscoso y un ácido inorgánico fuerte. Es uno de los ácidos minerales y es uno de los 20 productos químicos más importantes en la industria química. Como aditivo alimentario, tiene el número E 513 .Ácido sulfúrico diluido se llama ácido diluido. Hasta el siglo XIX, el ácido sulfúrico también tenía el nombre trivial de aceite de vitriolo (derivado de vitriolos), que ya no se usa en la actualidad.
Las sales y ésteres del ácido sulfúrico se llaman sulfatos e hidrogenosulfatos. Los sulfatos similares a sales contienen el ion sulfato (SO4 ).
Obtención y visualización
En el pasado, el ácido sulfúrico se producía mediante el proceso de vitriolo y el proceso de cámara de plomo. Los métodos modernos son el método de contacto y el método de doble contacto desarrollado a partir de él.
El proceso más antiguo para producir ácido sulfúrico es el proceso vitriolo. Fue utilizado por los alquimistas en el siglo XIII. Los vitriolos son sulfatos que se descomponen térmicamente con relativa facilidad para formar trióxido de azufre y un óxido metálico. Johann Rudolph Glauber (1604–1670) construyó la primera fábrica de ácido sulfúrico del mundo, que usó este proceso para producir ácido sulfúrico alrededor de 1650 en Nordhausen (Harz).
En el proceso de contacto, la producción se lleva a cabo en tres pasos, comenzando con azufre elemental (S) y oxígeno (O2 ) Dióxido de azufre (SO2 ) se muestra:
El dióxido de azufre se oxigena aún más con pentóxido de vanadio (V2 O5 ) como catalizador, al trióxido de azufre (SO3 ) implementado:
El trióxido de azufre es el anhídrido del ácido sulfúrico. Debido a su baja solubilidad en agua, no se introduce directamente en agua sino en ácido sulfúrico concentrado, por lo que se absorbe muy bien.
El ácido disulfúrico formado se diluye continuamente con agua.
Propiedades
Ácido sulfúrico de fórmula molecular H2 SO4 es un ácido fuerte (pKS1 =−3, pKS2 , que corresponde al pKS del anión sulfato de hidrógeno HSO4 =1,9). Como ácido inorgánico fuerte, es uno de los ácidos minerales. El ácido sulfúrico concentrado también es un poderoso agente oxidante. También es higroscópico y, por lo tanto, se puede utilizar para secar gases y líquidos. La molécula de ácido sulfúrico tetraédrica distorsionada tiene un gran momento dipolar, cuyo polo positivo se encuentra entre los dos grupos OH.
El ácido sulfúrico forma un azeótropo con agua. Si se calienta a ebullición ácido sulfúrico al 100 %, el trióxido de azufre se evapora hasta alcanzar una concentración de alrededor del 98 % en peso. Por el contrario, el ácido sulfúrico diluido se puede llevar a esta concentración hirviéndolo.
El ácido sulfúrico al 100 % se prepara burbujeando trióxido de azufre en aproximadamente el 98 % en peso de ácido sulfúrico hasta que esté anhidro. El ácido sulfúrico también puede unir grandes cantidades de trióxido de azufre, el líquido resultante se llama oleum debido a su alta viscosidad. Oleum consiste en una mezcla de ácido sulfúrico y ácidos polisulfúricos (ácido disulfúrico:H2 S2 O7 , ácido trisulfúrico H2 S3 O10 , etc.) El óleum con hasta un 65% en peso de trióxido de azufre está disponible comercialmente. El oleum se usa en reacciones químicas para la sulfonación o cuando es necesario unir la mayor cantidad de agua posible de la reacción. Esto minimiza el consumo de ácido sulfúrico y, a menudo, maximiza el rendimiento.
Para determinar la concentración, se mide la densidad del ácido sulfúrico. Por lo tanto, la concentración se puede deducir directamente de las tablas estándar. Por ejemplo, se determina el estado de carga de la batería de un automóvil (ver también batería de plomo-ácido).
Al diluir ácido sulfúrico concentrado, se libera mucho calor. Por lo tanto, se deben tomar las medidas de precaución adecuadas. Es importante que siempre el ácido el agua está mezclado, es decir, no el agua del ácido ! De lo contrario, el agua puede evaporarse de forma explosiva y provocar que el líquido salga disparado sin control; el peligro es evidente. La regla mnemotécnica:"Primero el agua, luego el ácido, de lo contrario ocurrirá lo monstruoso".
Significado y uso
El ácido sulfúrico es uno de los productos químicos más comúnmente producidos. En 1997 se produjeron más de 130 millones de toneladas en todo el mundo. Las posibles aplicaciones son muy diversas. Se utiliza ácido sulfúrico
- para digerir minerales (por ejemplo, en la digestión de óxido de titanio (IV) o uranio)
- para la producción de sulfatos
- para la producción de otros ácidos (por ejemplo, ácido fluorhídrico o ácido fosfórico)
- para la producción de fertilizantes a través de ácido nítrico
- para la producción de tensioactivos
- como catalizador
- para tratamiento de metales
- como desecante
- como auxiliar de reacción (ácido nitrante)
- en baterías de automóviles
- para grabar semiconductores
- por su conductividad como aditivo para agua en electrólisis
- como disolvente al fumar
- en análisis para determinar los índices de viscosidad de la poliamida
- para la producción de dióxido de titanio
En la industria alimentaria, el ácido sulfúrico se utiliza como aditivo técnico para producir almidón modificado y caseína y para tratar el agua potable. No fluye hacia el producto final y, por lo tanto, no está presente o solo está presente en trazas que son inocuas para la salud. En la Unión Europea, el ácido sulfúrico no tiene que declararse en el empaque del producto.
La disolución de permanganato de potasio en ácido sulfúrico hasta la saturación produce un líquido aceitoso de color verde oscuro (heptóxido de dimanganeso) que es un agente oxidante fuerte. Inmediatamente carboniza materiales orgánicos como la madera y se quema espontáneamente con acetona u otros combustibles. Al disolver el dicromato de potasio en ácido sulfúrico, se obtiene ácido sulfúrico crómico, una sustancia comúnmente utilizada en el pasado con fines de limpieza en los laboratorios.
La cantidad de ácido sulfúrico producido es un indicador de la eficiencia de la industria química de un país. Grandes cantidades de ácido sulfúrico se consumen en la II fase de desarrollo de la industria química.
Fases de desarrollo:
- I. Consumo predominante de sosa cáustica
- II. Consumo predominante de ácido sulfúrico tercero Consumo predominante de cloro
Estructura y unión
En la molécula de ácido sulfúrico, como en el anión sulfato de hidrógeno, el átomo de azufre tiene una coordinación tetraédrica distorsionada. Los dos enlaces S-O con los grupos OH son notablemente más largos que con los dos átomos de oxígeno "desnudos". Las longitudes de enlace encontradas corresponden a órdenes de enlace de 1 y 2. Sin embargo, en la notación de uso frecuente con enlaces dobles (covalentes) y sin cargas formales, el enlace de los cuatro átomos de oxígeno con el azufre no puede explicarse sin usar los orbitales 3d de se utilice el azufre para los enlaces π (cf. PSE). Sin embargo, consideraciones teóricas detalladas muestran que los orbitales d contribuyen poco al enlace en los compuestos de los elementos del grupo principal. Por lo tanto, el enlace más corto con los átomos de oxígeno "desnudos" se describe mejor como un enlace simple covalente, que se acorta por interacciones electrostáticas adicionales. La separación de carga se puede derivar de la estructura límite mesomérica única que obedece la regla del octeto.
Prueba
El ácido sulfúrico se puede detectar en forma de anión sulfato. Por ejemplo, la precipitación como sulfato de bario microcristalino poco soluble después de la adición de una solución de cloruro de bario sirve como detección de sulfato.
Conexiones importantes
Sales:
- Sulfato de cobre (vitriolo de cobre)
- Sulfato de calcio (yeso, alabastro, anhidrita) (CaSO4 )
- Sulfato de bario (barita, espato pesado) (BaSO4 )
- Alum (sulfatos de aluminio mezclados con otros cationes)
- Aluminita
- Sulfato ferroso (vitriolo ferroso)
- Sulfato de sodio (sal de Glauber)
Ésteres:
- sulfato de dimetilo (disolvente, agente de metilación; muy tóxico)
Fuentes
- ↑ Entrada sobre ácido sulfúrico en la base de datos de sustancias GESTIS de BGIA, consultada el 31 de marzo de 2007 (se requiere JavaScript)
- Ácido sulfuroso H2 SO3 (sulfito de dihidrógeno)
- Punto de rocío del ácido sulfúrico