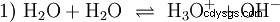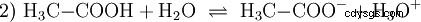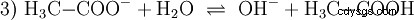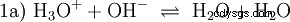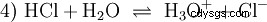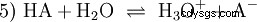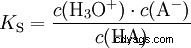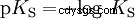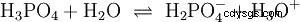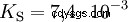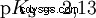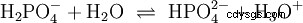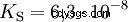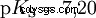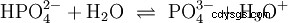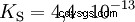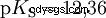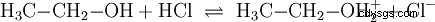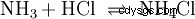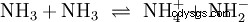ácidos son, en el sentido más estricto, todos los compuestos que pueden transferir protones (H) a un compañero de reacción; pueden actuar como donantes de protones. En solución acuosa, el reactivo es esencialmente agua. Iones de oxonio (H3 O), el pH de la solución se reduce. Los ácidos reaccionan con las llamadas bases para formar agua y sales. Por lo tanto, una base es lo opuesto a un ácido y es capaz de neutralizarlo.
En un sentido más amplio, diferentes conceptos ácido-base describen conjuntos mucho más amplios de reacciones químicas que pueden ir mucho más allá de las reacciones mencionadas anteriormente.
Evolución histórica de los ácidos
Probablemente el ácido más antiguo conocido (lat. acidum ) es vinagre (lat. acetum ), una solución acuosa aproximadamente al 5% del compuesto ácido acético. Los ácidos eran algo como el vinagre (oxos o ácido ). En alquimia, el ácido se consideraba una sustancia primordial . Las propiedades ácidas se basaron en un solo ácido úrico , que entró en vigor en diversas sustancias. Los ácidos hacen que la cal o los carbonatos formen espuma, tienen un efecto cáustico y un sabor a quemado. Aparte del vinagre y otros jugos de plantas, no se conocían ácidos hasta finales del siglo XIII. El conocimiento extenso de los ácidos se atribuyó a Geber, que vivió en el siglo VIII, pero se basa en escritos del mucho más joven, el llamado pseudo-Geber. [1]. Se desarrolló el conocimiento de varios ácidos inorgánicos, todos los cuales son variedades del elemento agua fueron atribuidos. A partir del siglo XVIII se los denominó ácidos minerales.
- Una producción de ácido nítrico (HNO3 ) probablemente fue utilizado por los pseudo-dadores después del siglo XIII como agua de disolución (aqua dissolutiva ) o agua fuerte (aqua fortis ) descrito. El vitriolo de cobre se calentó al rojo vivo con salitre y alumbre. Se escapan gases nitrosos, que forman ácido nítrico con el agua. Este ácido también fue llamado agua de separación , ya que disuelve la plata en una reacción química pero no el oro. En 1648, J. R. Glauber describió la producción de ácido nítrico concentrado (fumante) (spiritus acidus nitri ) por reacción con ácido sulfúrico.
- El agua regia, desde el punto de vista actual una mezcla de ácido nítrico y clorhídrico, probablemente se conoció desde el principio, ya que se puede obtener con relativa facilidad haciendo reaccionar el ácido nítrico con la conocida sal amoniacal. Aqua regia fue la reina de todos los ácidos , ni siquiera el oro, el rey de los metales , pudo resistir.
- Ácido sulfuroso (H2 SO3 ) ciertamente se conoce desde hace mucho tiempo, ya que se puede obtener quemando azufre elemental. El ácido sulfúrico ciertamente también estuvo presente en muchos procesos. Procesos más detallados para preparar ácido sulfúrico (H2 SO4 ) fueron descritos por primera vez con más detalle por A. Libavius en 1597:a) recocido de sulfato de hierro o cobre con vitriolos (Oleum vitrioli , ácido sulfúrico fumante) y b) combustión de azufre y posterior oxidación que da como resultado soluciones diluidas (Oleum sulfuris ) dirigió. Una implementación técnica tuvo éxito en el siglo XIX con el proceso de cámara de plomo.
- El ácido clorhídrico (HCl) como compuesto independiente solo se conoció a fines del siglo XVI. A. Libavius describió una síntesis al encender una mezcla de sal común y arcilla. B. Valentinus describió la conversión de vitriolo y sal común en aqua caustica , el agua corrosiva. Las intensas investigaciones de J. R. Glauber en el siglo XVII llevaron al fantasma de sal de Glauber (Spiritus salis Faithrianus ) del muy concentrado, llamado fumar ácido clorhídrico o el gas cloruro de hidrógeno.
El importante término base como equivalente fenomenológico de los ácidos fue utilizado en el siglo XVII por alquimistas como G. E. Stahl, R. Boyle y GF Rouelle, porque las sustancias "básicas" tienen la no volatilidad Base para la fijación de ácidos volátiles formado y puede neutralizar el efecto (corrosivo) de los ácidos. A. L. Lavoisier, quien asignó ciertas propiedades a ciertos compuestos químicos, dio pasos fundamentales en la química en el siglo XVIII. Pensó que los ácidos siempre se formaban a partir de óxidos no metálicos y agua, y las bases a partir de óxidos metálicos y agua. J. von Liebig, por otro lado, vio a los ácidos como compuestos de hidrógeno que los metales pueden convertir en sales.
En 1887, S. Arrhenius definió los ácidos como sustancias que al disolverse en agua liberan protones (H) y las bases como sustancias que al disolverse en agua liberan iones de hidróxido (OH). Cuando se combinan ácidos y bases, se neutralizan entre sí para formar agua. Sin embargo, la teoría seguía siendo insuficiente, ya que no se incluían compuestos sin oxígeno:el amoníaco también neutraliza un ácido. En 1923, J. N. Brønsted y T. Lowry describieron de forma independiente lo que sigue siendo la definición más importante de ácidos y bases en la actualidad. Forman la base de las explicaciones ácidas a continuación.
Propiedades de los ácidos
- Los ácidos atacan particularmente los metales básicos y la cal. Pero la ropa, la piel y los ojos (todos los materiales orgánicos en general) también están en riesgo en caso de contacto. ¡Precaución! Las quemaduras químicas siempre pueden ocurrir. ¡Use gafas de seguridad!
- Hay ácidos fuertes y débiles. El ácido clorhídrico es un ácido fuerte. El ácido acético es un ácido menos fuerte y el ácido carbónico es un ácido débil.
- Los ácidos se pueden diluir con agua, pero su efecto se vuelve significativamente más débil dependiendo de la dilución. La dilución de ácidos concentrados es una reacción exotérmica. Se genera mucho calor y la solución ácida puede rociarse sin control. Por lo tanto, al diluir, se aplica la regla de agregar el ácido al agua, no al revés:"Primero el agua, luego el ácido, de lo contrario sucederá lo monstruoso. “
- Es una falsedad común que los ácidos son siempre líquidos. Los representantes bien conocidos de los ácidos que están presentes puramente como sólidos son la vitamina C y el ácido cítrico.
- Los ácidos vuelven rojo el papel tornasol azul.
- Los "oponentes de los ácidos" son las bases (solución base =lejía). Pueden neutralizar los ácidos. Las bases también son cáusticas y atacan muchas otras sustancias que no necesariamente reaccionan con los ácidos.
- Los ácidos, cuando se disuelven en agua, conducen la electricidad. Aquí tiene lugar una electrólisis, en la que se forma hidrógeno en el cátodo (el polo -) y la sustancia neutralizada del ion residual ácido (anión ácido) se forma en el ánodo (el polo +), por ejemplo, cloro en el caso de ácido clorhídrico. La reducción (aceptación de electrones) ocurre en el cátodo y la oxidación (pérdida de electrones) ocurre en el ánodo.
¿Qué son los ácidos?
Sin profundizar en varios conceptos ácido-base una forma posible y común de ver las cosas debe describirse aquí como una introducción. generalmente está estrechamente relacionado con los ácidos y a menudo sin mención explícita la presencia y ciertas propiedades del agua. El agua pura está sujeta a lo que se conoce como autoprotólisis. Los iones de oxonio (H3) se forman a partir del agua en cantidades muy pequeñas e iguales O) e iones de hidróxido (OH):
Esta ecuación de reacción del agua muestra la propiedad de un ácido, es decir, la capacidad de formar H3 Iones O en agua. Al mismo tiempo, se forman iones OH en el agua. Una de las cualidades que puede tener una base. Sin embargo, el agua no se llama base ni ácido y su comportamiento se llama neutral . Esto se refiere al pH, que es la concentración de H3 indica iones O en el agua. El agua pura tiene un pH de 7, una concentración muy pequeña. Como todas las reacciones descritas en esta sección, esta reacción es una reacción de equilibrio:la formación de los iones y su combinación para formar agua tiene lugar constantemente y con la misma frecuencia. Neutral no significa que no pase nada.
Los ácidos son compuestos químicos que pueden interactuar con el agua de cierta manera. Tienen átomos de hidrógeno que están enlazados como iones (ionogénicos). Así es como el ácido acético puro (H3 C-COOH) con agua y forma más H3 O iones. Cuando ocurre tal reacción, un compuesto puede llamarse ácido. Además del ion oxonio, también se forma el anión acetato H3 Director de operaciones:
El ácido acético es un ácido carboxílico y un ácido bastante débil en comparación con los ácidos inorgánicos como el ácido clorhídrico. En solución acuosa, una gran proporción de las moléculas se encuentran sin disociarse como H3 C-COOH antes. También aquí se establece rápidamente un equilibrio. Por esta razón, la ecuación de reacción anterior (2) se puede leer de derecha a izquierda con igual justificación. Un anión acetato reacciona con un ion oxonio para formar agua y ácido acético. En esta dirección de lectura se produce una reacción básica en cambio:La conversión de iones de hidroxonio en moléculas de agua. Si se añade a una solución de ácido acético una cantidad adecuada de aniones acetato, por ejemplo en forma de acetato de sodio fácilmente soluble, la propiedad ácida del ácido acético puede compensarse completamente con la propiedad básica del ion acetato. La solución acuosa se neutraliza. Neutral no significa que no pase nada en la solución. Solo la concentración del H3 Los iones O son tan bajos como en el agua pura.
Además, la reacción básica ser considerado, que ocurre cuando el acetato de sodio está en estado puro el agua se disuelve:
Aquí se forman iones de hidróxido (OH). Agregar una cantidad apropiada de solución acuosa de ácido acético a esta solución de acetato hace que la solución sea neutral . Se encuentra entre H3 O y OH entran en el equilibrio (1) presentado inicialmente como una propiedad fundamental del agua y representado como la Ecuación (1a) invertida.
| Un ácido puede entenderse como un compuesto químico que tiene la capacidad en solución acuosa H3 para formar iones O o convertir iones OH en moléculas de agua. Una base, por otro lado, tiene la capacidad de formar iones OH o H3 en solución acuosa. O a H2 O. |
Muchas sustancias a las que se hace referencia como ácidos son soluciones acuosas desde el principio y no pueden entenderse fácilmente como compuestos químicos que tienen átomos de hidrógeno unidos iónicamente. El ácido clorhídrico es una solución acuosa del gas cloruro de hidrógeno (HCl) y se considera un ácido fuerte. En esta solución, antes de cualquier uso práctico del ácido, ya existe el equilibrio (4), en el que el equilibrio está casi completamente en el lado derecho.
El cloruro de hidrógeno hace tiempo que agotó su potencial para ser un ácido y H3 Se forman iones O. Los efectos químicos que se producen a partir de la aplicación práctica del ácido clorhídrico se deben a reacciones de H3 atribuido a los iones O. El ácido es el H3 O ión. El valor de pH es aquí la medida de la acidez (concentración), mientras que en el caso de ácidos más débiles, como el ácido acético, la medida de la fuerza del ácido, el valor pKa, está en primer plano. Los ácidos fuertes y débiles difieren en su tendencia a "similar" o "menos parecido" al H3 para formar iones O en agua. La sección Equilibrio ácido-base describe estas tendencias con más detalle.
| El efecto químico en el uso práctico de un ácido es principalmente sobre H3 O iones de vuelta. Se pueden considerar los iones de oxonio como el ácido más importante. |
Equilibrio ácido-base
Durante la protólisis, un reactivo (generalmente agua) absorbe el protón emitido por el ácido. Esto debe distinguirse de las reacciones redox en las que tienen lugar transferencias de electrones.
La reacción de equilibrio general de un HA ácido en solución acuosa es:
Los ácidos difieren en su tendencia a transferir iones H al agua. Esto se llama Fuerza del ácido k s denota e indica la constante de equilibrio (constante de ácido) de la reacción ácida. La constante de acidez a menudo se da en forma de pK s -valor, que se define como el logaritmo negativo de la constante de acidez.
Ácidos con K mayúscula s -valor (pequeño pK s -valor) son ácidos fuertes. Si el pH de una solución que contiene un ácido está dos unidades por debajo del pK s valor, sólo una centésima parte de la H3 Se formaron iones O.
Ácidos polibásicos
Los ácidos que pueden separar varios protones se llaman ácidos polipróticos . Ácido sulfúrico (H2 SO4 ) es un ácido fosfórico diprótico (también diprótico) (H3 PO4 ) un ácido triprotónico (también triprotónico). El intento de liberar los protones individuales (protólisis) varía en tamaño y se puede calcular utilizando la constante de ácido (Ks ) describir. En general, lo siguiente se aplica a los pasos de protólisis individuales:Ks (I)> Ks (II)> Ks (III) (o pKs (yo)
Para ácido fosfórico:
pKS -Valores de ácidos importantes
Reacciones ácido-base sin agua
Análogamente a las reacciones ácido-base que tienen lugar en soluciones acuosas y con la participación de agua, existen reacciones en otros medios. En el etanol anhidro, tiene lugar una reacción con cloruro de hidrógeno, en la que el etanol desempeña el papel de base:
En la fase gaseosa, los gases amoníaco y cloruro de hidrógeno reaccionan para formar la sal cloruro de amonio.
Además del agua, otros disolventes suficientemente polares también pueden actuar como reactivos en las reacciones ácido-base. Un buen ejemplo es la autoprotólisis del amoníaco líquido:
Ejemplos de ácidos
Los ácidos importantes son:
- Ácido sulfúrico:H2 SO4 (uso industrial, lluvia ácida)
- Ácido clorhídrico:HCl (uso industrial)
- Ácido fosfórico:H3 PO4 (Industria alimentaria, incluida la cola, material genético)
- Ácido carbónico:H2 CO3 (industria alimentaria, tecnología, atmósfera)
- Ácido acético:CH3 COOH (industria alimentaria)
- Ácido fluorhídrico:HF (fabricación de chips informáticos)
- Ácido nítrico:HNO3 (uso industrial)
Las sales de ácidos polibásicos también pueden actuar como ácidos ("sales ácidas"), por ejemplo
- Bisulfatos
- Fosfatos de hidrógeno
Referencias
Desarrollo histórico de los ácidos:
- Claus Priesner, Karin Figala:Alquimia:Enciclopedia de una ciencia hermética. Beck, Múnich 1998, ISBN 3406441068
- V. Karpenko, J.A. Norris:Vitriol en la historia de la química. Chem. Listy, Vol. 96, 2002, páginas:997-1005 [2]
- Donantes en Britannica
- Lista de ácidos
- bases
- Conceptos ácido-base